
8.已知R原子有3个电子层,最外层电子数是其K、L两电子层电子数之和的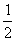 ,则R元素的氧化物对应水化物的化学式不可能是
( )
,则R元素的氧化物对应水化物的化学式不可能是
( )
A.HRO3 B.H3RO3 C.H3RO4 D.H2RO4
7.在常温、常压下,两个容积相同的烧瓶M、N中,分别通入下列四组气体(见图和表)当打开A处的夹子使两种气体充分接触后,两烧瓶内的压强由大到小的顺序是 ( )
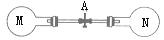
|
组编号 |
① |
② |
③ |
④ |
|
M中气体 |
H2 |
H2S |
NH3 |
NO |
|
N中气体 |
Cl2 |
SO2 |
HCl |
O2 |
A.①<②<③<④ B.②<④<①<③
C.③<②<④<① D.③<①<④<②
6.某有机物的结构简式为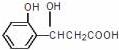 ,它可以发生的反应类型有 ( )
,它可以发生的反应类型有 ( )
(a)取代 (b)加成 (c)消去 (d)酯化
(e)水解 (f)中和 (g)缩聚 (h)加聚
A.(a)(c)(d)(f) B.(b)(e)(f)(h)
C.(a)(b)(c)(d)(f) D.除(e)(h)外
5.铝元素在下列反应中被还原的是 ( )
A.NaAlO2+HCl+H2O====NaCl+Al(OH)3↓
B.2Al+2H2O+2NaOH===2NaAlO2+3H2↑
C.3Fe3O4+8Al 4Al2O3+9Fe
4Al2O3+9Fe
D.2Al2O3 4Al+3O2↑
4Al+3O2↑
4.硅能与下列试剂反应的是 ( )
①浓氨水 ②浓氢氧化钠 ③浓硝酸 ④氢氟酸
⑤氟气 ⑥浓硫酸
A.②④⑤ B.①② C.②③⑥ D.②④⑥
3.为了分离黑火药(KNO3、S、C)的各个成分所选用的试剂是 ( )
A.苯和酒精 B.水和二硫化碳
C.水和酒精 D.浓硫酸与二硫化碳
2.下列元素中,最高正化合价数值最大的是 ( )
A.碳 B.氮 C.氧 D.氟
1.2009年10月,诺贝尔化学奖得主Venkatruaman Ramakrishnan、Thomas Steitz和Ada Yonath三位科学家都采用了X射线蛋白质晶体学的技术,标识出了构成核糖体的成千上万个原子。这些科学家不仅让我们知晓了核糖体的“外貌”,而且在原子层上揭示了核糖体功能的机理。对于原子的概念叙述正确的是 ( )
A.不能再分的最小微粒 B.保持物质化学性质的最小微粒
C.化学变化中不能再分的最小微粒 D.构成物质的最小微粒
10.(1)二氧化硫的催化氧化的过程如图所示,其中a、c二步的化学方程式可表示为:
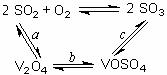
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是 (写化学式)
(2)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如下图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3 2SO2+O2 在550 ℃时的平衡常数K= 。
2SO2+O2 在550 ℃时的平衡常数K= 。
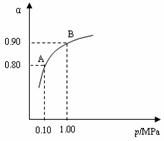
(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度 B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)维持温度不变条件下使之发生如下反应:2SO2+O2 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
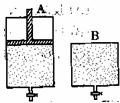
试填写下列空格:
A容器达到平衡时所需的时间比B容器__________(填:“短或长”);平衡时A容器中SO2的转化率比B容器_______(填:“大或小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数_________(填“增大”、“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数_________。
9.某校化学实验兴趣小组为了探究在实验室制备 Cl2 的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置 ( 支撑用的铁架台省略),按要求回答问题。
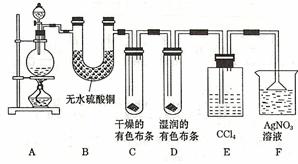
(1)下列方法中,可制得氯气的正确组合是 。
(已知酸性条件下,K2Cr2O7、、KClO3的氧化性均强于Cl2;酒精灯可以不用)
① MnO2 和浓盐酸混合共热; ②次氯酸钠和浓盐酸混合 ;
③K2Cr2O7 和浓盐酸混合; ④KClO3 和浓盐酸混合共热;
⑤KMnO4和浓盐酸混合;
A.只有① B.只有①⑤ C.只有①③④⑤ D.全部可以
(2)若用含有0.2 mol HCl 的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是 。
(3)①装置B的作用 , 现象是 。
②装置C和D出现的不同现象说明的问题是 。
③装置E的作用是 。
④写出装置F中发生反应的离子方程式 。
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性 , 证明最终通入 AgNO3 溶液的气体只有一种 , 乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在 与 之间(填装置字母序号), 装置中应放入 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com