
21.(10分)
铁单质及其化合物在生活、生产中应用广泛。请回答:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应是 。
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是 。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是 (用离子方程式表示)。在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降除去,其原因是 。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4 + 4 CO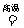 3 Fe + 4 CO2 ,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。
3 Fe + 4 CO2 ,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。
(5)下表中,对陈述I、II的正确性及其有无因果关系的判断都正确的是 (填字母)。
|
|
陈述I |
陈述II |
判断 |
|
A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
I对;II对;有 |
|
B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁得到铁 |
I对;II对;无 |
|
C |
铁属于过渡元素 |
铁和铁的某些化合物可用作催化剂 |
I错;II对;无 |
|
D |
在空气中铁表面形成致密氧化膜 |
铁不能与氧气反应 |
I对;II对;有 |
20.(7分)
一定条件下,在体积为3 L的密闭容器中反应CO(g)+2H2(g)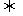 CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K= ;根据下图,升高温度,K值将 (填“增大”、“减小”或“不变”)。
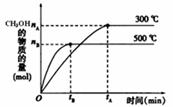
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是_________(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是 (填字母)。
a.v生成(CH3OH)= v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母)。
a.c(H2)减少
b正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡时c(H2)/ c(CH3OH)减小
19.(7分)
下表是元素周期表的一部分,表中所列字母分别代表短周期中的一种元素:
|
|
|
|
|||||
|
|
|
|
|
A |
B |
|
|
|
C |
|
D |
|
|
|
|
|
(1)A单质电子式是 ;B元素在周期表中的位置是 。
(2)D单质与C的最高价氧化物对应水化物反应的离子方程式是 。
(3)A的气态氢化物与其最高价氧化物对应水化物反应所得产物的名称是 ,该产物对水的电离起促进作用的原因是 。
18.锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲 33.6L (标准状况)。将反应后的溶液稀释至1 L,测得溶液的pH=1,下列叙述不正确的是( )
A.反应中共消耗1.8 mol H2SO4 B.甲中SO2与H2的体积比为4:1
C.反应中共消耗97.5 g Zn D.反应中共转移3 mol电子
第Ⅱ卷 (非选择题 共58分)
17.下列关于电解质溶液的叙述正确的是 ( )
A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)>c(NH4+)>c(H+)=c(OHˉ)
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.将pH = 4的盐酸稀释后,溶液中所有离子的浓度均降低
16.M的名称是乙烯雌酚,它是一种激素类药物,结构简式如下。下列叙述不正确的是( )
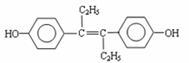
A.M的分子式为C18H20O2
B.M可与NaOH溶液或NaHCO3溶液均能反应
C.1 mol M最多能与7 mol H2发生加成反应
D.1 mol M与饱和溴水混合,最多消耗5 mol Br2
15.下列离子方程式中书写正确的是 ( )
A.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:
Ba2+ + OH- + H+ + SO42- = BaSO4↓+ H2O
B.NH4HCO3溶液与过量KOH浓溶液共热:NH4++ OH- NH3↑+ H2O
NH3↑+ H2O
C.稀硝酸和过量的铁屑反应:3 Fe + 8H+ +2 NO3- = 3 Fe3+ +2 NO↑+ 4 H2O
D.KI溶液与H2SO4酸化的H2O2溶液混合:2 I- + H2O2 + 2 H+ =2 H2O + I2
14.短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列比较正确的是
( )
A.元素非金属性:Z> Y > X B.最高价氧化物水化物酸性:Z > Y
C.原子半径:Z < Y < X D.气态氢化物的稳定性:Z < Y < X
13.下列说法正确的是 ( )
A.2.24 L CO2中含有的原子数为0.3×6.02×1023
B.1.8 g NH4+ 含有的质子数为6.02×1023
C.30 g乙酸和甲酸甲酯的混合物中含有的共价键数为4×6.02×1023
D.7.8 g Na2O2中含有的阴离子数为0.2×6.02×1023
12.下列相关实验不能达到预期目的的是 ( )
|
|
相关实验 |
预期目的 |
|
A |
相同温度下,等质量的大理石块、大理石粉分别与等体积、等浓度的盐酸反应 |
探究接触面积对化学反应速率的影响 |
|
B |
把装有颜色相同的NO2和N2O4混合气的两支试管(密封)分别浸入冷水和热水中 |
探究温度对化学平衡的影响 |
|
C |
在蔗糖中加入稀硫酸,水浴加热,再加入新制的氢氧化铜并加热 |
探究蔗糖水解产物具有还原性 |
|
D |
两支试管中装有等体积、等浓度H2O2溶液,向其中一支试管中加入CuSO4溶液 |
探究CuSO4溶液对H2O2分解速率的影响 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com