
3.下列有机物命名正确的是 ( )
A.二溴乙烷 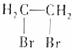
B.3-乙基-1-丁烯 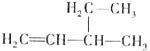
C.2-甲基-2,4-己二烯 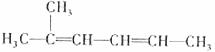
D.2,2,3-三甲基戊烷 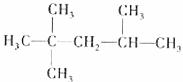
2.以下四种标签,适合贴在无水乙醇试剂瓶上的是 ( )
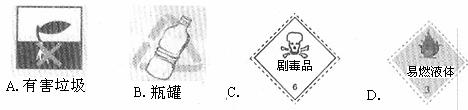
1.化学与生活、社会密切相关。下列说法正确的是 ( )
A.用NaOH溶液雕刻工艺玻璃上的纹饰
B.Na2O可用于呼吸面具中作为氧气的来源
C.工业上硝酸可用于制化肥、农药、炸药和染料等
D.向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量
29.(19分)为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,某化学兴趣小组设计了下图所示的实验装置和实验方案(有些夹持仪器已省略)

(1)图中虚线框内所含玻璃仪器有酒精灯、导管和 。
(2)点燃酒精灯一段时间后,A、B中可观察到明显的现象。B中的现象是 。
(3)开始时A中发生反应的化学方程式为 。(任写一个)
(4)装置C的作用是 。
(5)装置D中所装试剂的名称为 。
(6)若实验中称取铁碳合金样品的质量为mg,反应结束时E管增重bg,则此合金中铁的质量分数为 (写表达式)。
(7)老师指出,按上述实验装置实验会存在较大的误差,产生误差的主要原因是
①有部分二氧化碳会溶解在装置B、C的溶液中;
② ;
③ 。(再写出两种原因即可)
28.(15分)中学常见物质A、B、C、D、E之间的转化关系如图所示。其中A、D、E为单质,B、C为化合物。

(1)若A为主族金属,D为非金属,且常温呈固态。则反应①的化学方程式为 。
(2)若A、D常温下呈气态,则反应①的化学方程式为 。
(3)若反应①需要在高温下才能进行,且A、D属于同主族非金属,则B、C两种物质相比,熔点较低的是 (填化学式),原因是 。
(4)若D为液态非金属,且反应中n(A):n(B)=3:2,则反应①的离子方程式为 ;E可能为 或 。
27.(14分)U、W、X、Y、Z是原子序数依次增大的短周期主族元素,U、Z原子的电子层数与最外层电子数之比分别为1:2和1:1,U和W可以形成两种常见气态化合物A和B,X、Y、Z可组成离子化合物C,其最具特征的晶体结构单元(晶胞)的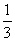 如下图所示。
如下图所示。
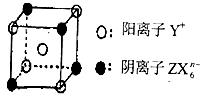
(1)W、X、Y、Z形成的四种简单离子的半径由大到小有顺序是 。(用离子符号回答)
(2)只由U一种元素可以形成多种阴离子,其中常见的一种的电子式为 。
(3)化合物C的化学式为 。
(4)向Na2SiO3溶液中缓慢通入过量化合物B,溶液中现出浑浊,该反应的离子方程式是 。
(5)化合物A通入PdCl2的水溶液中会有Pd单质和另外两种常见化合物生成。该反应的化学方程式是 。
26.(12分)请将下列五种物质:KBrO3、Br2、I2、KI、K2SO4分别填入下列对应的横线上,组成一个未配平的化学方程式:
______+______+ H2SO4 → ______+______+______+KBr +H2O ;
(1)该反应中的还原产物是 (填写化学式);
(2)如果该反应方程式中I2 和 KBr的系数分别是8和1,则配平后的化学方程式为
。
(3)如果该反应方程式中Br2和KBr的系数分别是a和b,则I2的系数为
(4)若氧化剂与还原剂按物质的量之比6:5也能恰好完全反应,请推测原因:
。
13.下图是某一水溶液的pH从0至14的范围内,H2CO3、HCO-3、CO2-3三种成分平衡时的组成百分率,下列叙述正确的是 ( )
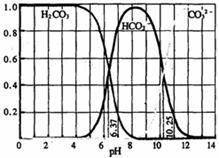
A.此图可完全根据1.0mol·L-1HCl溶液滴定1.0mol·L-1碳酸钠溶液的实验数据绘出
B.H2CO3和CO2-3在溶液中不能大量共存
C.等体积的1.0mol·L-1HCl溶液和1.0mol·L-1碳酸钠溶液混合后溶液呈中性
D.在pH为6.37时,溶液中:c(H2CO3)=c(HCO-3),c(CO2-3)=0
12.如下图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是 ( )
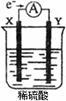
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C.X极上发生是还原反应,Y极上发生的是氧化反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
11.下列实验可达到实验目的的是 ( )
A.将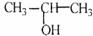 与NaOH的醇溶液共热制备CH3-CH=CH2
与NaOH的醇溶液共热制备CH3-CH=CH2
B.乙酰水杨酸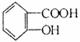 与适量NaOH溶液反应制备
与适量NaOH溶液反应制备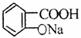
C.向CH3CH2Br中滴入AgNO3溶液以检验溴元素
D.用无水乙醇和乙酸共热制备乙酸乙酯
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com