
12.关于铅蓄电池的说法正确的是 ( )
A.在放电时,正极发生的反应是:Pb(s) +SO42 -(aq)= PbSO4(s) +2e-
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是:PbSO4(s)+2e-= Pb(s)+ SO42-(aq)
11.等浓度的下列溶液中,c(NH4+)最大的是 ( )
A.NH4NO3 B.NH4HSO4
C.(NH4)2Fe(SO4)2 D.(NH4)2CO3
10.用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥构成一个原电池。以下有关该原电池的叙述正确的是 ( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③ C.②④ D.③④
9.250℃和1.01×105Pa时,反应 2N2O5(g) 4NO2(g)+O2(g);△H=+56.76kJ/mol,自发进行的原因是 ( )
4NO2(g)+O2(g);△H=+56.76kJ/mol,自发进行的原因是 ( )
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.熵增效应大于焓增效应
8.已知反应:①2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是 ( )
A.碳的燃烧热为110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
7.某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,通过水解除去杂质,需将溶液调至pH=4,在调节溶液pH值时,应选用的试剂是 ( )
A.NaOH B.ZnO C.Na2CO3 D.Fe2O3
6.物质的量浓度相等的下列溶液pH值由大到小的顺序是 ( )
A.Na2CO3、NaHCO3、NaCl、NH4Cl
B.Na2CO3、NaHCO3、NH4Cl、NaCl
C.Na2CO3、NaCl、NH4Cl、NaHCO3
D.Na2CO3、NH4Cl、NaHCO3、NaCl
5.在配制Fe2(SO4)3溶液时,为抑制水解常常往溶液中加入少量的 ( )
A.NaOH B.H2SO4 C.KCl D.CH3COOH
4.常温下,将等体积、等浓度的盐酸和氨水混合后所得溶液的pH ( )
A.等于7 B.大于7 C.小于7 D.无法确定
3.在密闭容器里,A与B反应生成C,其反应速率分别用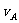 、
、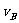 、
、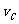 表示,已知2
表示,已知2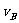 =3
=3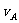 、3
、3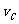 =2
=2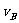 ,则此反应可表示为 ( )
,则此反应可表示为 ( )
A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.A+B=C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com