
8.下列各组离子在指定环境下一定能大量共存的是 ( )
A.滴入甲基橙显红色的溶液中:K+、Fe3+、SO42-、NO3-
B.pH=0的溶液中:Na+、K+、S2-、SO32-
C.在水电离出的c(H+)=10-12mol·L-1溶液中:Na+、NH4+、HCO3-、SO42-
D.加入一小块钠后没有沉淀生成的溶液中:K+、Al3+、SO42-、AlO2-
7.NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.24g镁原子的最外层电子数为NA
B.CO和N2组成的28g混合气体中含有4NA 个原子
C.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA Fe3+
D.一定条件下SO2(g)+ 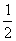 O2(g)
O2(g)  SO3(g);△H=-98.3kJ/mol,若反应放出19.66 kJ热量,则有0.2NASO2被氧化
SO3(g);△H=-98.3kJ/mol,若反应放出19.66 kJ热量,则有0.2NASO2被氧化
6.下列叙述正确的是 ( )
A.溶液是电中性的,胶体是带电的
B.雾是气溶胶,在阳光下可观察到丁达尔效应
C.强电解质一定为离子化合物,共价化合物一定为弱电解质
D.某物质A的水溶液导电能力与盐酸相同,则可证明A为强电解质
29.(8分)将19gNa2CO3和NaHCO3的混凝土合物加热到质量不再减少时为止,称得剩余固体的质量为15.9g,求原混合物中Na2CO3的质量分数。
28.(8分)已知将氯气通入浓氨水中可以发生如下反应:3Cl2+8NH3=6NH4Cl+N2
(1)标出电子转移的方向和数目:
(2)当有17g的NH3被氧化时,生成的NH4Cl的质量是多少克?
27.(12分)工业生产的纯碱中常有少量的NaCl等杂质,下图是测定产品中的Na2CO3质量分数的实验装置,实验操作步骤有:
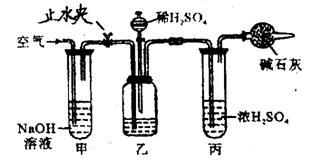
A.在干燥管内填满碱石灰,质量为mg(碱石灰易吸收CO2和H2O)
B.取ng 样品装入广口瓶中
C.检验装置的气密性
D.缓缓鼓入空气数分钟,再称干燥管质量为wg
E.关闭止水夹
F.打开止水夹
G.缓缓放入稀硫酸至不再产生气体为止
H.缓缓鼓入空气数分钟
(1)正确的操作顺序是(填写符号)C→B→F→( )→E→( )→G→( )→D
(2)操作步骤D中要缓缓鼓入空气数分钟,鼓入空气的作用是_____________
装置甲的作用是________________________;装置丙的作用是______________
(3)计算样品中Na2CO3的质量分数的计算式为______________________
(4)若去掉装置甲,测定结果会(填“偏大”,“偏小”或“无影响”,下同)_________
若去掉装置丙,测定结果会______________
26.(10分)有A、B、C、D四种无色溶液,它们分别是Na2CO3、Na2SO4、NaHSO4、BaCl2中的一种,为了确定各是何种溶液进行了下列实验,记录为:①A+D→溶液+气体,②B+C→溶液+沉淀,③B+A→溶液+沉淀X,④D+B→溶液Y+沉淀,⑤溶液Y+沉淀X→溶液+气体。
(1)根据以上记录确定:A_________B_________C__________D__________(填化学式)
(2)写出①、③、⑤各反应的离子方程式:
①______________________________
③______________________________
⑤_______________________________
25.(8分)某化合物粉末加到盐酸中产生无色无味的气体,对粉末进行焰色反应,结果为黄色。当无色无味气体为_________时,该化合物是__________;当无色无味气体为_______时,该化合物为_________。
24.(4分)氧化还原反应中不仅遵循原子守恒(质量守恒),而且也遵循电子转移守恒。在一定条件下,RO3n-与I-发生反应的离子方程式为:RO3n-+6I-+6H+=R-+3I2+3H2O则:RO3n中R的化合价为___________,n的值为___________。
23.(6分)根据化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO2+4H2O
回答下列问题:
(1)该反应的氧化剂是___________,被氧化的元素是________
(2)被还原的HNO3与参加反应的HNO3质量比是_________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com