
2.下列关于电解池的说法正确的是
A.电源的负极就是阴极
B.与直流电源正极相连的是电解池的阴极
C.与直流电源负极相连的电极上发生还原反应
D.阳极上发生还原反应
1.下列说法正确的是
A.反应焓变是指1mol物质参加反应时的能量变化
B.当反应放热时,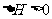 ,反应吸热时,
,反应吸热时,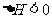
C.在加热条件下发生的反应均为吸热反应
D.一个化学反应中,当反应物能量大于反应产物能量时,反应放热,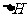 为“-”
为“-”
22.(10分)碳、氮元素及其化合物与人类的生产生活密切相关。试回答下列有关问题:
(1)NH3极易溶于水,其水溶液俗称氨水。用水稀释0.1mol·L-1的氨水,溶液中随着水量的增加而减小的是 (填序号)。
A.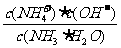 B.
B.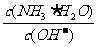
C.c(H+)·c(OH-) D.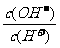
(2)标准状况下,将1.12LCO2通入100mL mol·L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为 ;
用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+ ;
②c(H+)+c(Na+)= 。
(3)甲烷燃料电池中发生的化学反应为:CH4+2O2=CO2+2H2O,该电池的电解质溶液为H2SO4溶液,则原电池工作时电解质溶液中向正极移动的离子是 。
21.(12分)如图甲、乙是电化学实验装置。

(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为 ;
②乙中总反应的离子方程式为 ;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为 。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为 ;
②如果起始时乙中盛有200mLpH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入 (填写物质的化学式) g。
20.(8分)已知五种周期元素在周期表中的相对位置如下表所示:
|
a |
|
|
|
|
|
|
|
|
|
|
|
b |
|
c |
|
d |
|
|
e |
(1)上述元素中离子半径最大的是 (填元素符号)。
(2)已知A、B、C、D、E五种化合物均由上述元素中的几种组成。它们之间的转换关系如图所示,且A、B、E三种物质含有相同的一种金属元素,C和D分别是常见的强酸和弱碱,则:①A、B、E所含的该金属元素的原子结构示意图为 ;
②若将D逐滴滴入A的溶液中至过量,反应过程中的离子方程式依次为 。
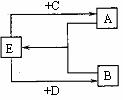
19.(8分)中学常见的某反应的化学方程式为A+B→C+D+H2O(未配平,反应条件略去)。请回答下列有关问题。
(1)若A是铁,B是稀硝酸(过量),且A可溶于C溶液中。则A与C反应的离子方程式为
。
(2)若C、D均为气体,且都能使澄清石灰水变浑浊,则上述反应的化学方程式为
。
(3)若C是无色刺激性气味的气体,其水溶液呈弱碱性。C能发生催化氧化反应,写出该反应的化学方程式 。
(4)若D为氯碱工业的主要原料,C是造成温室效应的主要气体之一,则上述的反应的化学方程式为 。
18.(11分)反应①:Fe(s)+CO2(g) FeO(s)+CO(g)△H=akJ·mol-1,平衡常数为K;
FeO(s)+CO(g)△H=akJ·mol-1,平衡常数为K;
反应②:CO(g)+1/2O2(g)=CO2(g) △H=bkJ·mol-1
测得在不同温度下,K值如下:
|
温度/℃ |
500 |
700 |
900 |
|
K |
1.00 |
1.47 |
2.40 |
(1)若500℃时进行反应①,CO2起始浓度为2mol·L-1,CO的平衡浓度为 。
(2)反应①中的a 0(填大于、小于、等于)。
(3)700℃反应①达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有 (填序号)
A.缩小反应器体积 B.通入CO2
C.升高温度到900℃ D.使用合适的催化剂
(4)下列图像符合反应①的是
(填序号)(图中v是速率、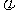 为混合物中CO含量,T为温度且T1>T2)
为混合物中CO含量,T为温度且T1>T2)
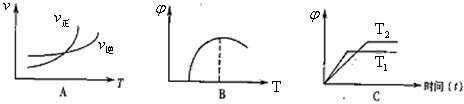
(5)由反应①和②可求得,反应2Fe(s)+O2(g)=2FeO(s)的△H= 。
17.(11分)某校化学实验兴趣小组欲采用如图所示的实验装置制备Cl2,同时进行与氯气有关的某些实验,按要求回答问题。
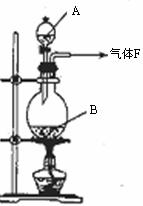
(1)A是浓盐酸,B为二氧化锰,将A滴入B中时发生反应的离子方程式为 ;
(2)甲同学用含有0.2molHCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下)小于1.12L,这是由于反应过程中盐酸浓度变小造成的。请列举导致盐酸浓度变小的原因: 。
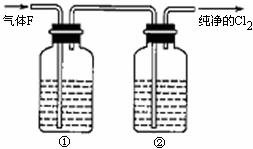
(3)在实验室中,乙同学欲用下图中的装置净化氯气,则瓶①②中应盛放的试剂分别是① ,
② (填试剂名称)。
(4)丙同学将纯净的Cl2通入一定量石灰乳中来制取漂白粉,若通入224mL(标准状况下)Cl2完全反应,则反应过程中转移电子的物质的量为 。
16.在溶液中有浓度均为0.01mol·L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:
Ksp[Fe(OH)3]=2.6×10-39mol4·L-4;Ksp[Cr(OH)3]=7.0×10-31mol4·L-4
Ksp[Zn(OH)2]=1.0×10-17mol3·L-3;Ksp[Mg(OH)2]=1.8×10-11mol3·L-3
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小 ( )
A.Fe3+ B.Cr3+ C.Zn2+ D.Mg2+
第Ⅱ卷(非选择题,共60分)
15.有四种物质的量浓度相等、且都由一价阳离子A+和B+及一价阴离子X-和Y-组成的盐溶液。据测定常温下AC和BY溶液的pH=7,AY溶液的pH>7,BX溶液的pH<7。由此判断可能不水解的盐是 ( )
A.BX B.AX C.AY D.BY
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com