
7.在下列物质的溶液中分别加入一定量的Na2O2固体,不会出现浑浊现象的是( )
A.饱和Na2CO3溶液 B.Ca(HCO3)2稀溶液
C.Na2SO3稀溶液 D.饱和CaCl2溶液
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,5.6L四氯化碳含有的分子数为0.25NA
B.标准状况下,14g氮气含有的核外电子数为5NA
C.标准状况下,22.4L任意比氢气和氯气的混合气体中含有的分子总数均为NA
D.标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA
5.化学概念在逻辑上存在下图所示关系;对下列概念的说法正确的是( )
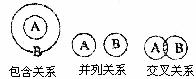
A.纯净物(B)与混合物(A)属于包含关系
B.化合物(B)与氧化物(A)属手包含关系
C.单质与化合物属于交叉关系
D.氧化反应与化合反应属于并列关系
4.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的是( )
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、SCN-
B.pH为1的溶液:Cu2+、Na+、Mg2+、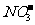
C.pH为13的溶液:K+、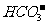 、Br-、Ba2+
、Br-、Ba2+
D.所含溶质为Na2SO4的溶液:K+、[Al(OH)4]-、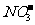 、Al3+
、Al3+
3.能正确表示下列化学反应的离子方程式的是( )
A.金属铝溶于盐酸中:Al+2H+=Al3++H2↑
B.向漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.在标准状况下2.24LCO2通入1mol·L-1100mLNaOH溶液中:CO2+OH-=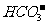
D.碳酸镁溶于硝酸中:CO32-+2H+=H2O+CO2↑
2.下列各物质中,前者是纯净物,后者是混合物的是( )
A.水煤气、铝热剂 B.硫酸铜晶体、漂白粉
C.盐酸、磷酸钙 D.玻璃、含Fe为70%的氧化铁
1.下列说法正确的是( )
A.可用丁达尔现象区分溶液与胶体
B.生石灰与水混合的过程只发生物理变化
C.O3是由3个氧原子构成的化合物
D.CuSO4·5H2O是一种混合物
23.将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C+H2O(g) CO+H2。
CO+H2。
C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
H2(g)+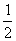 O2 (g)= H2O(g) △H2=-242.0kJ·mol-1
O2 (g)= H2O(g) △H2=-242.0kJ·mol-1
CO(g)+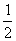 O2 (g)=CO2(g) △H3=-283.0kJ·mol-1
O2 (g)=CO2(g) △H3=-283.0kJ·mol-1
试回答:
(1)请你根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式:
____________________________
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和比1molC(s)完全燃烧放出的热量_______ (填“多”或“少”)。
甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量。”
乙同学根据盖斯定律作出了下列先循环图
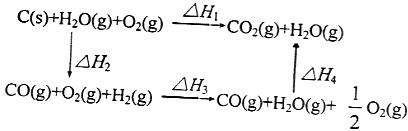
请你写出△H1、△H2、△H3、△H4之间存在的关系式_____________________。乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同。”请分析:甲、乙两同学观点正确的是_____________ (填甲或乙)同学,另一同学出现错误观点的原因是_____________________
22.(8分)在0.5L密闭容器中,一定量的氨气和氢气进行如下化学反应:N2(g)+3H2(g)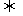 2NH3(g);△H<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g);△H<0,其化学平衡常数K与温度T的关系如下表:
|
T/℃ |
200 |
300 |
400 |
|
|
K |
K1 |
K2 |
0.5 |
|
请完成下列问题:
(1)试比较K1、K2的太小,K1_______ K2 (填“>”、“=”或“<”)。
(2)下列各项能作为判断该反应达到化学平衡状态的依据的是_______ (填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2,
b.v正(N2)=3v逆(H2)
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)400℃时,反应2NH3(g)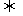 N2(g)+3H2(g)的化学平衡常数K的值为_______。当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的v正(N2) _______ v逆(N2) (填“>”、“<”或“=”)
N2(g)+3H2(g)的化学平衡常数K的值为_______。当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的v正(N2) _______ v逆(N2) (填“>”、“<”或“=”)
21.(12分)两只密闭容器A和B,A能保持恒压,B能保持恒容,起始时向容积相等的A、B中分别通入体积比为2:1的等量的SO2和O2,使之发生反应:2 SO2+O2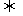 2SO3,并达到平衡。按要求(填>、=、<;正、逆;增大、减小、不变)回答:
2SO3,并达到平衡。按要求(填>、=、<;正、逆;增大、减小、不变)回答:
(1)达到平衡所需要的时间:t(A)_______t(B),SO2的转化率 A_______
A_______ B
B
(2)起始时两容器中的反应速率v(A)_______v(B),
反应过程中的反应速率:v(A)_______v(B)。
(3)达到平衡时,在两容器中分别通入等量的Ar气。A中的化学平衡向_______反应方向移动。B中的化学反应速率_______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com