

24.(12分)Cu、Cu2O和CuO组成的混合物,加入100
mL 0.6mol·L-1HNO3溶液恰好使混合物溶解,同时收集到224mL NO气体(标准状况)。求:
(1)写出Cu2O跟稀硝酸反应的化学反应方程式 。
(2)产物中硝酸铜的物质的量 mol。
(3)如混合物中含0.01 mol Cu,则其中Cu2O、CuO的物质的量分别是 mol、
mol。
23.(14分)现用U型管(用硬质玻璃管弯制)、干燥管、酒精灯、胶塞和玻璃导管等仪器设计下图装置来证实稀硝酸与铜反应生成NO。
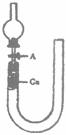
(1)补充完成下列实验步骤:
①检查装置的气密性,方法是 。
②打开活塞A,从U型长管一端注入稀硝酸,一直注到 为止。
③关闭活塞A,用酒精灯在U型管短管一侧加热,当观察到 现象时,立即停止加热。
(2)记录描述观察到的实验现象:
①可在U型管短管上方处观察到 色气体产生。若铜丝和稀硝酸均未完全反应,在 时反应也可自行停止。
②反应自行停止后,如果慢慢打开活塞A,可立即观察到 。以上现象说明 。
22.(18分)某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
填写下面空白。
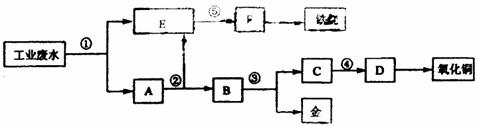
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ 。
(2)写出①处发生反应的离子方程式 。
(3)铁红的化学式为 ;
写出铁红在工业上的一种主要用途:铁红 。
21.(16分)已知A、B、C三种元素均为短周期元素,且它们的原子序数关系为:A<B<C,A元素原子的最外层电子数是次外层电子数的2倍,B和C可形成BC4型化合物,用化学符号回答:
(1)A是 B是 C是 。
(2)它们的最高价氧化物对应的水化物分别是(写分子式) 、 、 ,其中酸性最强的是(写分子式) 。
(3)BC4的电子式是 。
(4)用化学方程式表示如何用B的氧化物制取B的最高价氧化物对应的水化物 。
20.将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成一气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为 ( )
A.1mol B.0.05mol C.1.05mol D.0.11mol
19.0.5 mo1硝酸铵在一定条件下可分解成0.2mol硝酸和16.2g水以及另外一种气态物质,该气态物质可能是 ( )
A.NO B.N2O C.N2O3 D.N2
18.某无色混合气体,依次通过浓硫酸和过氧化钠,气体体积不断减少,颜色变深,则混合气体的组成是 ( )
A.H2O(g)、NO和N2 B.NO2、CO2和 H2O(g)
C.O2、HCI和CO D.NH3、NO和CO2
17.某无色溶液可能由Na2CO3、NaCl、NaHCO3、BaCl2 BaCl的一种或几种混合而成,往溶液中加入烧碱溶液出现白色沉淀,加入稀H2SO4也出现白色沉淀,据此分析,下述组合判断中正确的是 ( )
①肯定有BaCl2 ②可能有NaCl ③肯定有NaHCO3
④肯定有Na2CO3或NaHCO3 ⑤肯定没有NaCl
A.①②③ B.①③ C.②④ D.①③⑤
16.用26.4g(NH4)2SO4跟过量的Ca(OH)2混合加热,放出的气体全部被含有39.2g的H3PO4溶液吸收,生成的盐是 ( )
A.(NH4)3PO4 B.NH4H2PQ,
C.(NH4)2HPO4 D.(NH4)3PO4和NH4H2PO4
15.下面是几条规律的叙述:
①原子半径增大;
②元素氢化物的稳定性减弱;
③元素单质的还原性增强;
④元素单质的导电性由绝缘体一半导体一导体。
符合上述规律的元素组是 ( )
A.O、S、Se B.S、Se、Fe C.Cl、Br、I D.S、Cl、Br
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com