
7.下列元素的最高价氧化物溶于水,形成的含氧酸的酸性最强的是 ( )
A.原子最外层电子数是次外层的2倍的元素
B.原子M层电子数等于另两层电子数之差的元素
C.第三周期ⅦA族的元素
D.其单质有多种同素异形体,其中一种着火点很低、能自燃的元素
6.如图所示,在注射器中加入少量Na2SO3晶体,并吸收少量浓硫酸(以不接触纸条为准),则下列有关说法正确的是( )
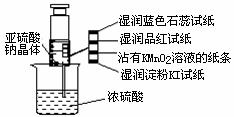
A.蓝色石蕊试纸先变红后褪色
B.沾有KMnO4溶液的滤纸褪色,证明了SO2的漂白性
C.湿润淀粉KI试纸变蓝
D.品红试纸褪色证明了SO2的漂白性
5.在一定的温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原来的温度,下列说法正确的是 ( )
A.溶液中Na+浓度增大,有O2放出 B.溶液中OH-总数不变,有O2放出
C.溶液的pH增大,有O2放出 D.溶液中Na+总数减少,有O2放出
4.下列的比较顺序中,不正确的是 ( )
A.热稳定性:HF>HCl>HBr>HI
B.微粒半径:K+>Na+>Mg2+>Al3+
C.碱性:CsOH>RbOH>KOH>NaOH
D.熔点:Li<Na<K<Rb
3.下列有关0.1 mol·L-1NaOH溶液的叙述正确的是 ( )
A.1L该溶液中含有NaOH 40g
B.100mL该溶液中含有OH- 0.01mol
C.从1L该溶液中取出100mL,所取出的NaOH溶液的浓度为0.01 mol·L-1
D.在1L水中溶解4g Na OH即可配制得0.1 mol·L-1NaOH 溶液
2.“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是 ( )
A.非金属单质燃烧时火焰均为无色
B.只有金属单质灼烧时火焰才有颜色
C.焰色反应均应透过蓝色钴玻璃观察
D.NaCl与Na2CO3灼烧时火焰颜色相同
1.金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有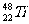 和
和 关的说法中正确的是 ( )
关的说法中正确的是 ( )
A.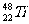 和
和 原子中均含有22个中子
原子中均含有22个中子
B.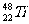 和
和 为同一核素
为同一核素
C.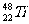 和
和 在周期表中位置相同
在周期表中位置相同
D.分别由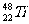 和
和 组成的金属钛单质互称为同分异构体
组成的金属钛单质互称为同分异构体
23.常温下,Ba(OH)2和NaOH混合溶液的pH=14,取该溶液100mL,持续通入CO2,当通入的CO2体积为0.56L时生成沉淀最多,试通过计算回答(气体体积均在标准状况下测得,设溶液体积在反应过程中不发生变化):
(1)混合溶液中NaOH的物质的量浓度各是多少?
(2)当通入的CO2总体积为2.24L时,溶液中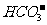 、
、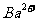 的物质的量浓度各是多少?
的物质的量浓度各是多少?
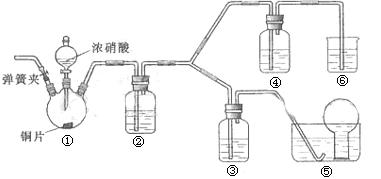
22.(11分)某学习小组探究浓、稀硝酸氧化性的相对强弱的。按下图装置进行试验。
实验表明浓硝酸能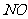 氧化成
氧化成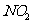 ,而稀硝酸不能氧化
,而稀硝酸不能氧化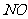 。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。
已知氢氧化钠溶液不与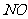 反应,
反应,
能与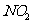 反应
反应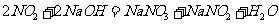
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是________、________、________。
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹以及_________
_____________________________________________。
(3)装置①中发生反应的化学方程式是_______________________________。
(4)装置②的作用是 ,发生反应的化学方程式是________________。
(5)该小组得出结论依据的试验现象是_______________________________。
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)___________________
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
21.(8分)下表是元素周期表中短周期部分,表中所列字母分别代表一种元素。
|
A |
|
|
|
|
|
|
|
|
|
|
|
B |
C |
D |
E |
|
|
F |
|
|
|
|
|
G |
H |
(1)上述元素的单质中熔点最高的元素名称是 ,F、G、H中原子半径最小的元素符号是 ,E、F、G离子半径由小到大的顺序是 , F的离子结构示意图__________(本小题用化学用语及名称回答)。
(2)A、B、D、F四种元素组成的受热易分解的化合物,写出少量该化合物溶液与足量Ba(OH)2溶液反应的离子方程式 。
(3)常温下,ACD3和盐A4C2D3的水溶液pH均为6。则两种水溶液中由水电离出的H+ 浓度之比是 。
(4)化学反应3A2(g)+C2(g)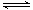 2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),图中表示反应速率与反应过程的关系,其中表示平衡混合物中CA3含量最高的一段时间是 __
。温度为T℃时,将4mol A2和2mol C2放入1L密 闭容器中,60s后测得C2的转化率为50%,则A2的反应速率为 。
2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),图中表示反应速率与反应过程的关系,其中表示平衡混合物中CA3含量最高的一段时间是 __
。温度为T℃时,将4mol A2和2mol C2放入1L密 闭容器中,60s后测得C2的转化率为50%,则A2的反应速率为 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com