
2.下列有关物质分类或归类正确的是 ( )
①混合物:盐酸、漂白粉、水玻璃、水银
②化合物:CaCl2、NaOH、HCl、HD
③电解质:胆矾、石膏、冰醋酸、乳酸
④同素异形体:C60、C70、金刚石、石墨
⑤同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑥硅酸盐:正长石、水晶、玻璃、水玻璃
A.①③④ B.②③④ C.③④ D.②④⑥
1.化学与生产、生活、社会密切相关。下列说法不正确的是 ( )
A.2009年诺贝尔物理学奖授予英国华裔科学家高锟,瑞典皇家科学院说,高锟在“有关光在纤维中的传输以用于光学通信方面”取得了突破性成就,其中光导纤维的原料为硅晶体
B.“问题奶粉”的问题主要是奶粉中掺杂了三聚氰胺,它不是蛋白质,分子结构如下图所示,其含氮量高达66.7%
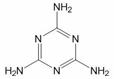
C.神七宇航员翟志刚所穿航天服由我国自行研制的航空材料做成,其主要成分由碳化硅、陶瓷和碳纤维复合而成,是新型无机非金属材料
D.2008年北京奥运会开幕式上的“脚印”焰火让全世界为之倾倒,它主要是利用了化学中焰色反应的有关知识
28.(10分)在537℃、1.01×105 Pa时,往容积可变的密闭容器中充入1 mol X和3 mol Y,此时容积为V L。保持恒温恒压,发生反应X(g)+3Y(g) 2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
(1)达到平衡时,X的转化率约为 。
(2)保持上述温度和压强恒定不变,若向容器中只充入4 mol Z,则反应达到平衡时,平衡气体中Y 的体积分数为 ,容器的容积为 L。
(3)若另选一容积固定不变的密闭容器,仍控制温度不变,使2 mol X和6 mol Y反应,达到平衡时平衡气体中Z的体积分数仍为0.5,则该密闭容器的容积为 。
(4)若温度仍为537℃,容器体积保持VL不变(恒容),往其中充入a mol X的b mol Y,使反应达到平衡,这时平衡气体中Z的体积分数仍为0.5,体系压强为1.01×105 Pa,若a: b = 1: 3,则a = 。
27.已知:HCN的结构为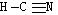 ,R-CN
,R-CN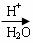 RCOOH,R-Cl+CN-→R-CN+Cl-(R为烃基)。玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
RCOOH,R-Cl+CN-→R-CN+Cl-(R为烃基)。玉米芯、甘蔗渣等废物水解发酵后可制得糠醛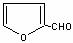 ,它是重要的化工原料,它在一定条件下可发生以下变化:(12分)
,它是重要的化工原料,它在一定条件下可发生以下变化:(12分)
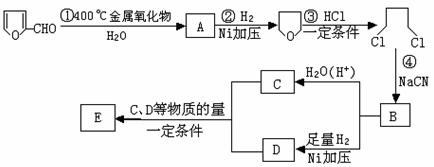
(1)写出反应类型:② ,④ 。
(2)写出反应③的化学方程式: ;
写出能证明糠醛中含有醛基的一个化学反应方程式 。
(3)若E为环状化合物,则其结构简式 。
(4)若E为高聚物,则其结构简式 。
26.(12分)已知X和Y各是由两种常见元素组成的化合物,A、B为气体,G为白色沉淀,F是一种两性氢氧化物,在电解开始时,溶液中有白色 沉淀产生,但随着电解的进行,白色沉淀逐渐溶解,最后变为澄清溶液C(有两种溶质),X、W、C、E的焰色反应均为黄色。各物质之间的关系如图所示(部分产物已经省略,除气体间的反应外,其余反应均在溶液中进行)。
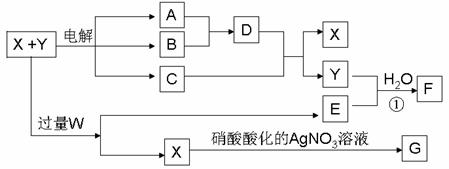
回答下列问题:
(1)X、Y、W的化学式分别为 . .
(2)写出反应①的离子方程式
(3)A与B反应生成1 mol D时放出热量为92.3 kJ,则此反应的热化学方程式为
(4)向澄清溶液C中加入10 mol·L-1的硫酸,当加至50 mL时才开始出现沉淀,假设电解过程中溶液体积变化忽略不计,原X和Y混合液的体积为100 mL,Y溶液的物质的量浓度为a mol·L-1,则X溶液的物质的量浓度为 mol·L-1(含a代数式表示)
25.(9分)工业制备高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
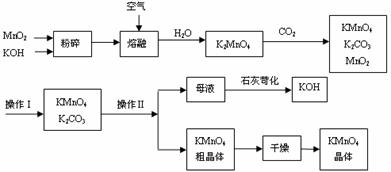
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是____(填代号)。
a.84消毒液(NaClO溶液) b.双氧水 c.苯酚 d.75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是______(填代号)。
a.浓硝酸 b.硝酸银 c.氯水 d.烧碱
(3)上述流程中可以循环使用的物质有 、 (写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 mol KMnO4。
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2,所需试剂最好选择(选填代号) 。
a.石灰石 b.稀HCl c.稀H2SO4 d.纯碱
(6)操作Ⅰ的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在 (填性质)上的差异,采用 (填操作步骤).趁热过滤得到KMnO4粗晶体。
24.(11分)已知:氧化性:KMnO4>HNO3;Bi 元素+3价较稳定,Na3BiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下。
①滴加适量的Na3BiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)Bi元素在周期表中的位置 ;
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为 ;
(3)实验④中的现象为: ;
(4)实验②反应的离子方程式是: ;
(5)实验③反应的离子方程式是:_ 。
23.现有用离子交换膜和石墨作电极的电解槽电解饱和的Na2SO4溶液生产NaOH和H2SO4,下列说法中正确的是 ( )
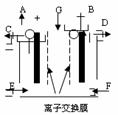
A.气体A是H2 ,溶液E是稀硫酸
B.气体B是H2 ,溶液D是NaOH溶液
C.Na2SO4 溶液由G口加入,F口通入稀硫酸
D.要定期补充水,不用补充Na2SO4
|
22.天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如下图所示下列说法错误的是 ( )
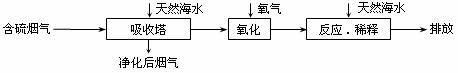
A.天然海水pH ≈ 8的原因是由于海水中的CO32-、HCO3-水解
B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42-
C.“反应、稀释”时加天然海水的目的是中和,稀释经氧化后海水中生成的酸
D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同
21.某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是 ( )
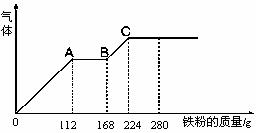
A.混合液中NO3-的物质的量为0.2 mol
B.OA段产生是NO,AB段反应为2Fe3++Fe = 3Fe2+,BC段产生氢气
C.溶液中最终溶质为FeSO4
D.c(H2SO4)为5 mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com