
29.(12分)将绿矾晶体加强热,除生成水蒸气以外,还发生: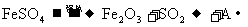 。
。
(1)请完成该反应方程式:____________________________________________。
(2)若将生成的混和气体通过氯化钡溶液,发生的现象是______________________。
(3)由于SO2制A的反应 ,为了提高SO2的转化率和加快反应速率,从理论上分析应选择的条件是_________________________________;而工业生产实际条件是_________________________________。若在一等压容器发生该反应,判断反应达到平衡状态的标志是______________________。(填字母)
,为了提高SO2的转化率和加快反应速率,从理论上分析应选择的条件是_________________________________;而工业生产实际条件是_________________________________。若在一等压容器发生该反应,判断反应达到平衡状态的标志是______________________。(填字母)
a.SO2和A浓度相等 b.SO2的百分含量保持不变
c.容器中气体的压强不变 d.A的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(4)为验证分解生成的固体是Fe2O3,可将其溶于适量稀HCl(恰好完全反应)配成溶液。在该溶液中滴加KSCN溶液的现象是___________________;若在该溶液中加入NaHCO3溶液生成红褐色沉淀,则离子方程式是______________________。
28.(14分)某课外活动小组为验证稀硝酸与铜反应的还原产物是NO,设计了如下图所示装置,请回答:
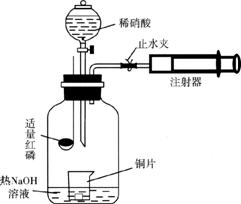
(1)盛稀硝酸和红磷的仪器名称分别是___________、___________。
(2)操作步骤有:①关闭止水夹;②点燃红磷,伸入瓶中,塞好胶塞;③向广口瓶内注入足量热NaOH溶液;④待红磷充分燃烧,一段时间后打开旋塞,向烧杯中滴入少量稀硝酸;⑤将注射器中空气压入;⑥将盛有Cu片的小烧杯放入瓶中;⑦打开止水夹。正确的操作顺序是_________________________________。
(3)把燃烧着的红磷伸入广口瓶的目的是_________________________________;化学反应方程式是____________________________________________。
(4)注射器压入空气前热NaOH溶液的作用是_________________________________,其反应的离子方程式是____________________________________________。
(5)将注射器中空气压入广口瓶中(空气过量)观察到的现象是_______________。
(6)注射器中空气压入后,迅速抽取广口瓶中气体,取下注射器并堵住前端口,再快速推活塞,能观察到的现象是__________________________________________。
27.(16分)A为有机物,从A出发可发生如下图所示的一系列反应。已知A能使石蕊试液变红,A分子中苯环有两个取代基,其苯环上的一氯代物有二种;D不能跟NaHCO3溶液反应,但能跟NaOH溶液反应。
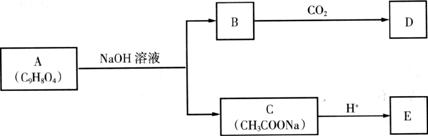
请回答:
(1)A的结构简式___________;1mol A在加热条件下与NaOH溶液完全反应时消耗___________mol NaOH。
(2)E的两种同分异构体Q、R都能在一定条件下发生银镜反应,R能与Na反应放出H2,而Q不能。Q、R的结构简式为Q___________、R___________。
(3)B生成D的反应方程式为____________________________________________。
(4)无水C和烧碱反应生成的气体在有机物中分子量最小,另一无机产物是_________。
(5)已知E的取代产物F(BrCH2COOH),F水解后生成G(HOCH2COOH),请写出G生成六元环酯的反应方程式:____________________________________。
(6)已知: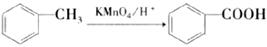
请选择适当物质设计一种合成方法,用对甲基苯酚经两步反应合成有机物A,在下图的方框中填写有机物的结构简式。
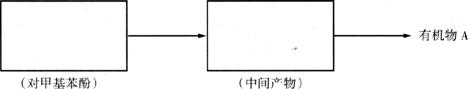
26.(18分)A、B、C、D、E是5种短周期元素,它们的原子序数依次增大,其中A、C及B、E分别是同主族元素,又知B、E两元素的原子核中质子数之和是A、C两元素原子中质子数和的2倍,这5种元素的单质中有2种气体,3种固体。
(1)写出元素符号:A___________,C___________。
(2)写出C在B中的燃烧产物的颜色是___________,电子式为___________。
(3)用A元素的单质和B元素的单质可以制成电池,电池中装有浓KOH溶液,用多种的惰性电极浸入KOH中,两极均有特制的防止气体透过的隔膜,在一极通入A的单质,另一极通入B的单质,通入B单质的一极的电极反应方程式是____________________________________________。
(4)写出2种均含A、B、C、E四种元素的化合物相互反应逸出气体的化学方程式_______________________________________________________。
(5)已知D的氧化物能分别溶解在强酸、强碱的水溶液中,写出D的氧化物与NaOH溶液反应的离子方程式:____________________________________________。
13.下列说法正确的是
①用25mL酸式滴定管可以准确放出8.00mL的稀盐酸
②可用干燥的pH试纸测定氯水的pH值
③使用容量瓶配制溶液,定容时俯视,所得溶液的浓度偏大
④加入盐酸有能使澄清石灰水变浑浊的无色气体生成,则原溶液中一定有大量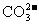 存在
存在
⑤在某温度下,一定量的醋酸与氢氧化钠溶液充分混合,若溶液呈碱性时,溶液中离子浓度大小的关系一定为: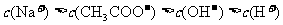
⑥下图是反应物和生成物的能量变化示意图,其可能发生反应的热化学反应方程式可表示为: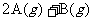

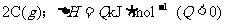 。
。
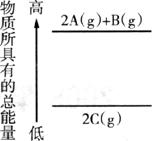
A.①③⑥ B.②④⑤ C.①③④ D.③⑤⑥
第Ⅱ卷(非选择题 共174分)
12.已知反应: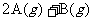

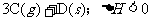 。下图中
。下图中 曲线表示在一定条件下,C的体积分数随时间变化的情况,若使曲线
曲线表示在一定条件下,C的体积分数随时间变化的情况,若使曲线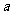 变成曲线
变成曲线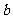 ,采取的措施是
,采取的措施是

A.升高温度 B.增大压强
C.增大A的物质的量 D.减小B的物质的量
11.下列有关溶液中相关量的关系描述一定正确的是
A.pH=2的盐酸和pH=12的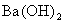 溶液混合后:p H=7
溶液混合后:p H=7
B.100mL 1.0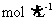
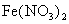 溶液和100mL 2.0
溶液和100mL 2.0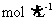 HNO3溶液混合后:
HNO3溶液混合后: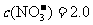
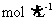
C.pH相等的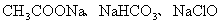 三种溶液:
三种溶液: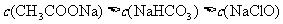
D.0.1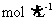 的KHA溶液,其pH=10:
的KHA溶液,其pH=10: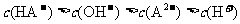
10.在一定条件下,氯气与碘单质以等物质的量进行反应,可得到一种红棕色液体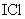 ,
,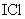 有很强的氧化性。现有下列两个反应:①
有很强的氧化性。现有下列两个反应:①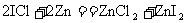 ;②
;②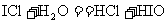 。下列有关叙述正确的是
。下列有关叙述正确的是
A.反应①中,当转移0.2 mol电子时牛成13.6g ZnCl2
B.反应①中,ZnI2既是氧化产物又是还原产物
C.反应①中,ZnCl2既是氧化产物又是还原产物
D.反应②中,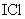 既是氧化剂又是还原剂
既是氧化剂又是还原剂
9.阿伏加德罗常数为NA,下列说法中正确的是
A.1.0 L 1.0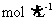 的NaAlO2溶液中含有的氧原子数为2NA
的NaAlO2溶液中含有的氧原子数为2NA
B.1.0 mol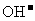 中含有的电子数为NA
中含有的电子数为NA
C.31g P4分子结构如下图所示中含有的P-P键个数为1.5NA

D.22.4 L N2中所含的分子数为NA
8.对水的电离平衡不产生影响的粒子是
A.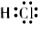 B.
B.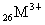 C.
C.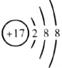 D.
D.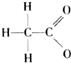
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com