

28.(19分)A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为固体、C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
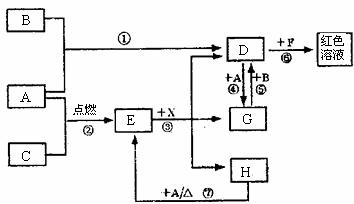
(1)写出下列物质的化学式:D ;X 。
(2)在反应①~⑦中,不属于氧化还原反应的是 (填编号)。
(3)反应④的离子方程式为: 。
(4)往G溶液中加入NaOH溶液观察到的现象是 。
(5)反应⑦的化学方程式为 ;该反应中每消耗0.3mol的A,可转移电子 mol。
(6)写出D的溶液与小苏打溶液反应的离子方程式 。
27.(10分)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10 。
在高锰酸钾酸性溶液和草酸(H2C2O4,弱酸)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显,但不久突然褪色,反应速率明显加快。
(1)请写出横线上所填物质的电子式: ,该反应中氧化剂是(填名称) ,写出草酸与足量NaOH溶液反应的离子方程式: 。
(2)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是 的影响。
(3)若用已知浓度的酸性KMnO4溶液滴定未知浓度的H2C2O4溶液,则KMnO4溶液应装在 (填仪器名称)中。
13.有镁、铝混合粉末25.5克,将它完全溶于600ml 5mol/L的盐酸溶液中,若要使沉淀质量达到最大值,则需加入2mol的NaOH溶液的体积为 ( )
A.1000ml B.500ml C.1500ml D.100ml
第Ⅱ卷
12.用0.1mol·L-1醋酸滴定0.1mol·L-1的氢氧化钠溶液,滴定过程中不可能出现的结果是
( )
A.c(Na+)>c(CH3COO-),c(OH-)>c(H+) B.c(Na+)=c(CH3COO-),c(OH-)=c(H+)
C.c(CH3COO-)>c(Na+),c(OH-)>c(H+) D.c(CH3COO-)>c(Na+),c(H+)>c(OH-)
11.根据下列实验现象,所得结论正确的是 ( )
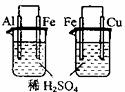
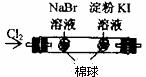
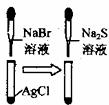
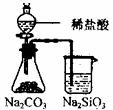
A B C D
|
实验 |
实验现象 |
结论 |
|
A |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
|
B |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
|
C |
白色固体先变为淡黄色,后变为黑色 |
溶解性:Ag2S>AgBr>AgCl |
|
D |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:Cl>C>Si |
10.向某液体中滴入少量NaHSO4溶液,析出沉淀,再滴入过量的NaHSO4溶液,沉淀又消失。此液体可能为
(1)Ba(OH)2溶液 (2)NaAlO2溶液
(3)Na2SiO3溶液 (4)Fe(OH)3胶体
A.(1)(3) B.(2)(4) C.(1) D.(1)(2)
B.(2)(4) C.(1) D.(1)(2)
9.以下对化学实验的描述合理的是 ( )
A.用加入浓溴水的方法分离苯和苯酚的混合物
B.中和滴定实验前,所使用的滴定管和锥形瓶必须洗净、干燥
C.制备FeCl3溶液时,先将固体溶于较浓的盐酸,再加水稀释
D.硫酸铜晶体里结晶水含量的测定实验中,盛晶体的坩埚灼烧后,需放在石棉网上冷却后称量
8.设NA为阿伏加德罗常数,下列叙述正确的是 ( )
A.常温下,1mol甲烷中含有NA个分子
B.28gNa2O2中阴、阳离子总数为4NA
C.0.1mol/L的醋酸钠中含有CH3COOH、CH3COO-粒子总数为0.1NA
D.0.1molCu与足量的硫发生反应,电子转移了0.2NA
7.下列离子方程式不正确的是 ( )A.醋酸钠的水解反应:CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
B.饱和碳酸钠溶液中滴加少量盐酸:CO-23+2H+=CO2↑+H2O
C.将钠投入冷水中:2Na+2H2O=2Na++2OH-+H2↑
D.在AlCl3溶液中滴加过量NaOH溶液:Al3++4OH-=AlO-2+2H2O
6.图1可表示“M与N的并列关系”,图2可表示“M属于N的从属关系”。下列概念间的关系符合图3所示关系的是 ( )
( )
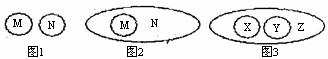
|
|
X |
Y |
Z |
|
A |
溶质 |
溶剂 |
溶液 |
|
B |
悬浊液 |
乳浊液 |
溶液 |
|
C |
酸性氧化物 |
碱性氧化物 |
氧化物 |
|
D |
饱和溶液 |
不饱和溶液 |
浓溶液 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com