
13.用铅蓄电池作电源电解某溶液100mL。已知该溶液中含SO2、KI,其物质的量的浓度均为0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是 ( )
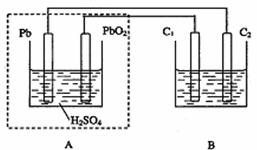
A.铅蓄电池工作一段时间后A溶液的PH变小
B.当B烧杯中I-的浓度降为0.05mol/L时,消耗A中的H2SO4的物质的量为0.025mol
C.当C1、C2两极均产生气体时,应有至少3.6×1022个电子从电路中流过
D.铅蓄电池工作时负极电极反应式为:PbO2-2e-+H2SO4 PbSO4+2H2O+SO42-
12.阿魏酸是一种广泛存在于植物中的酚酸,很多保键品中常含有阿魏酸,其结构简式如下:下列说法不正确的是 ( )
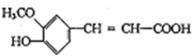
A.该化合物既可以与Br2的CCl4溶液发生加成又可以与浓溴水发生取代反应
B.该化合物具有还原性,能被过氧化物氧化,还能与氯化铁溶液反应
C.与阿魏酸分子式相同,且苯环上具有与阿魏酸相同取代基的化合物共有8种
D.阿魏酸乙酯的分子式为C12H14O
11.下列说法不正确的是 ( )
A.沸点由高到低的排列顺序:HF>HI>HBr>HCl
B.PCl3和BF3分子中所有原子的最外层都达到8电子稳定结构
C.H2O是极性分子,分子中O原子不处在2个H原子所连直线的中央
D.离子晶体可含有极性共价键,也可含有非极性共价键
10.下列离子方程式正确的是 ( )
A.向100mL 0.1mol/L的FeSO4溶液中,加入0.01mol Na2O2固体
2Fe2++2Na2O2+2H2O 4Na++2F(OH)2+O2↑
B.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全
2Al3++3SO42-+3Ba2++6OH- 2Al(OH)3↓+3BaSO4↓
C.苯酚钠溶液中通入少量CO2
CO2+H2O+2C6H5O- 2C6H5OH+CO32-
2C6H5OH+CO32-
D.向20mL 0.5mol/L FeBr2溶液中通入448mL Cl2(标准状况)
2Fe2++2Br-+2Cl2 2Fe3++4Cl-+Br2
9.下列说法不正确的是 ( )
A.CH3COONa与CH3COOH混合溶液呈中性,则溶液中有c(CH3COO-)=c(Na+)
B.NaHCO3溶液中有:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)
C.物质的量浓度均为0.1mol/L的Na2CO3和NaHCO3的混合溶液中有
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
D.常温下,pH为2的某酸HA与pH为12的某碱BOH等体积混合溶液呈酸性,则HA为强酸BOH为弱碱
8.12.8g Cu与过量的9mol/L,100mL HNO3反应,硝酸的还原产物为NO2和NO,反应结束后测得溶液中c(H+)=3mol/L,则反应后溶液中所含NO3-的物质的量 ( )
A.0.3mol B.0.5mol C.0.7mol D.0.75mol
7.用NA表示阿伏加德罗常数的数值,下列说法正确的是 ( )
A.25℃时,pH=12的1.0L NaClO溶液中水电离出了OH-的数目为0.01NA
B.标准状况下,22.4L甲醇中含有的氧原子数为1.0NA
C.标准状况下,22.4L氯气与足量NaOH溶液反应转移的电子数为2NA
D.同温同压下,原子数均为NA的氢气和氨气具有相同的体积
6.下列有关说法正确的是 ( )
A.用pH试纸可测得某溶液pH为6.5
B.可用25mL碱式滴定管量取20.00mL KMnO4溶液
C.石油、煤、天然气、可燃冰、植物油都属于化石燃料
D.把CO中毒的病人放人高压氧仓中解毒,其原理符合勒夏特列原理
30.(15分)2009年12月7日至18日在哥本哈根召开的世界气候大会,六十多个国家的领导人出席了会议,体现了气候变化越来越引起人们的重视。在这次会议中,如何降低大气中CO2的含量及有效地开发利用CO2,成为了其中一个重要的议题。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g);△H=-49.0kJ/mol
CH3OH(g)+H2O(g);△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
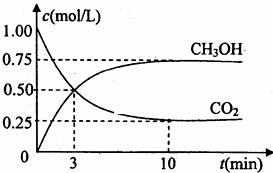
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
②某一时刻,测得反应放出的热量为24.5kJ,则此时CO2的转化率为 。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3molH2
(2)在载入航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O
则阴极反应式为: 。
(3)如果反应必在一个体积可变的密闭容器中进行,其余条件不变,则达到平衡时CO2转化率与(1)中相比 (填“增大”、“减小”、“不变”或“无法确定”)
29.(16分)某课外活动小组设计了如图所示的装置,用于进行缓慢电解NaCl溶液及相关实验(此时找开止水夹a,关闭止水夹b)。由于某些原因,实验开始并没有达到预期的目的,但也看到了令人高兴的现象(阳离子交换膜只允许阳离子和水的通过)。请帮他们分析原因,然后回答问题:
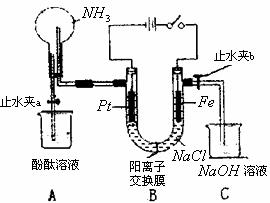
(1)写出B装置中的电极反应:
阴极: 阳极:
(2)一段时间内依次观察到A中的现象为:
① ② ③
(3)当观察完A中的现象后,打开水止夹b。再观察C装置,有无明显现象 (填“有”或“没有”),若无明显现象说明理由,若有现象请写出有关反应的化学方程式。
(4)若想达到电解NaCl溶液的目的,请对该装置进行最简单的改进 ;并写出电解饱和NaCl溶液的离子方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com