
6.下图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是 ( )
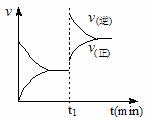
A.2SO2(g)+O2(g) 2SO3(g);△H<0
2SO3(g);△H<0
B.4NH3(g)+O2(g) 4NO(g)+6H2O(g);△H<0
4NO(g)+6H2O(g);△H<0
C.H2(g)+I2(g) 2HI(g);△H>0
2HI(g);△H>0
D.C(s)+H2O(g) CO(g)+H2(g);△H>0
CO(g)+H2(g);△H>0
5.下列各组分子中,都属于含极性键的非极性分子的是 ( )
A.CO2、H2S B.CCl4、CH4
C.Cl2、CCl4 D.NH3、HCl
4.已知反应A(g)+ 3B(g)== 2C(g)在某段时间内A的浓度变化的化学反应速率为1mol/(L min),则此段时间内以C的浓度变化的化学反应速率为 ( )
A.0.5 mol/(L ·min) B.1 mol/(L ·min)
C.2 mol/(L· min) D.3 mol/(L· min)
3.下列反应中生成物总能量高于反应物总能量的是 ( )
A.铝粉与氧化铁粉末反应 B.乙醇燃烧
C.碳酸钙受热分解 D.氧化钙溶于水
2.电解水时为了增强其导电性不应加入的电解质是 ( )
A.NaOH B.CuSO4 C.H2SO4 D.KNO3
1.下列关于铜电极的叙述正确的是 ( )
A.铜锌原电池中铜是负极
B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
30.(15分)A、B、C、D、E、F都是链状有机物,它们的转化关系如图所示。A中只含有一种官能团,D中含有两种官能团,D分子中不含甲基,且与碳原子相连的氢原子取代所得的一氯代物只有1种。请回答下列问题:
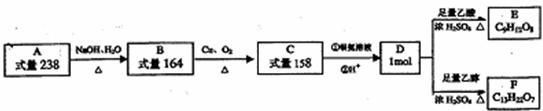
(1)D中含有官能团 ,D的分子式 。
(2)写出D的结构简式 ,A的结构简式 。
(3)写出B生成C的化学方程式 。
(4)写出C与银氨溶液反应的化学方程式
29.(15分)I.某硫酸厂进行硫铁矿(主要成分是FeS2)含量的测定。取样品0.1000g在空气中充分灼烧,将生成的SO2气体与足量的Fe2(SO4)3溶液反应,用度为0.02000mol/L的KMnO4溶液滴定至终点,消耗KMnO4 溶液30.00mL。
已知:SO2+2Fe++2H2O
SO42-+2Fe2++4H+
5Fe2++MnO4-+8H+
5Fe3++Mn2++4H2O
(1)滴定前是否要滴加指示剂? (填:“是”“否”)其理由是 。
(2)样品中FeS2的质量分数是 。(假定杂质不参加反应)
(3)若灼烧6g纯FeS2产生的SO2全部转化为SO3气体放出9.83KJ热量,产生的SO3与水全部化合生成硫酸,放出13.03KJ热量,写出SO3气体转化为硫酸的热化学方程式
。
Ⅱ.二氧化硫和氨的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一。
(1)用CH4催化还原NOx为N2可以消除氮氧化物的污染。试写出总反应方程式: ,现有1L NO、NO2混合气体,将其还原成N2,需同温同压下CH4的体积0.4L,则混和气体中NO、NO2的物质量之比为 。
(2)新型纳米材料氧缺位铁酸锌(ZnFe2Ox),常温下它能使工业废气中的氮的氧化物、SO2分解,减小工业废气对环境的影响,它可由铁酸锌(ZnFe2Ox)经高温还原制得。转化流程如图所示:
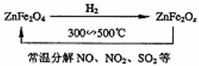
若2mol ZnFe2Ox与SO2可生成0.75mol S, x= 。写出由铁酸锌高温被H2还原生成氧缺位铁酸锌的化学方程式 。
28.(15分)已知元素周期表中六种元素,X、Y、Z、W、Q、R原子序数依次减小。回答下列问题:
(1)X元素与Y元素相邻,与X元素处于同一纵行的元素形成的单质的熔点、沸点随元素的原子序数的增大而增大,Y元素的含氧酸有多种,它的单质和氧化物都是强氧化剂,都可用作自来水的消毒剂,X位于周期表的 族,写出实验室制备Y的单质的化学方程式 。
(2)Y、Z、W三个原子的最外层共有11个电子,且三种元素形成的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水,写出Y、Z、W三种元素的最高价氧化物对应水化物反应的离子方程式。
(3)Q、R两元素单原子形成的离子在水中不存,与水作用使水溶液呈碱性,R形成单质的电子式为 ,W与R形成的化合物的化学式为 。它们的晶体属于 晶体。
(4)在一定温度下,R、Q形成的化合物在密闭容器中可发生下列反应:
2R2O3(g) 4RQ(g)+O2(g);反应到达平衡后,若恒容条件下通入一定量的氨气,则R2O3的转化率
,若在恒压条件下通入一定量的氨气,则R2O3的转化率
。(填“增大”“减小”“不变”)
4RQ(g)+O2(g);反应到达平衡后,若恒容条件下通入一定量的氨气,则R2O3的转化率
,若在恒压条件下通入一定量的氨气,则R2O3的转化率
。(填“增大”“减小”“不变”)
27.(15分)实验室制乙烯通常采用95%的乙醇与浓硫酸(体积比为1:3)混合加热到
170℃方法制得,其制备原理可表示如下:
CH3CH2OH+H2SO4(浓)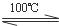 CH3CH2OSO2OH+H2O ①
CH3CH2OSO2OH+H2O ①
CH3CH2OSO2OH(浓)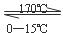 CH2=CH2↑+H2SO4 ②
CH2=CH2↑+H2SO4 ②
(1)浓硫酸在乙烯生成中作用为 ,反①属于 反应,反应②属于 反应。
(2)此法在实际操作中由于浓H2SO4的用量大、比热容高,加热至170℃所需时间长,有人将乙醇和浓H2SO4的混合液加热到80℃时,一次性投入一些小块的生石灰,大大缩短了反应所需时间,提高了乙烯的产率,试用速度和平衡理论解释之。
(3)反应过程中乙醇常被炭化,溶液中有黑色物质出现,随着反应进行炭化现象越来越严重,同时制得的乙烯气体中含有CO2、SO2等气体,为了减少反应过程中炭化现象又不影响乙烯的生成,下列措施合理的是 。
A.调速乙醇和浓硫酸的体积比为1:4
B.调整乙醇和浓硫酸的体积比为1:2
C.用大理石代替碎瓷片
D.降低反应体系温度至140℃
E.用其他脱水剂(如P2O5)代替浓硫酸
(4)为确认混合气体中含有乙烯和二氧化硫,有人设计下图实验装置。(可供选择的试剂:品红溶液、氢氧化钠溶液、溴水、酸性高锰酸钾溶液)
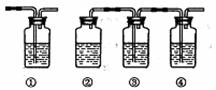
A.①②③④中可盛放的试剂分别为① ;② ;
③ ;④ ;
B.能说明二氧化硫气体存在的现象是 。
C.能确认含有乙烯的现象是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com