
9.布洛芬的结构简式为 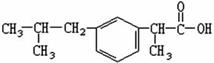 ,下列对该有机物的叙述正确的是 ( )
,下列对该有机物的叙述正确的是 ( )
A.是一种高分子化合物
B.一个该分子中最多有6个碳原子共面
C.苯环上的三氯取代产物是唯一的
D.1mol该有机物中分别加入适量Na、Na2CO3溶液恰好完全反应,相同条件下产生气体体积相同
8.下列反应的离子方程式书写正确的是 ( )
A.浓盐酸与MnO2共热制氯气:MnO2+2H++2Cl-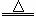 Mn2++Cl2↑+H2O
Mn2++Cl2↑+H2O
B.足量AlCl3溶液与纯碱溶液混和:2Al3++3CO32-+3H2O===2Al(OH)3↓+3CO2↑
C.已知还原性:Br-<Fe2+,在FeBr2溶液中通入一定量氯气:
2Fe2++6Br-+4Cl2===2Fe3++3Br2+8Cl-
D.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O===2C6H5OH+CO2-3
7.若NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.标准状况下,22.4L氟化氢中含有的分子数为NA
B.1mol二氧化硅中含有的Si-O键数目为2NA
C.45g羧基中含有的电子数目为23NA
D.将含1molFeCl3的溶液滴入沸水中,所制得的Fe(OH)3胶体粒子数为NA
6.下列说法正确的是 ( )
A.用漂白粉等氯制消毒剂杀灭甲流病毒,是因为氯能与病毒发生化合反应
B.含有食品添加剂的物质对人体健康均有害,不能食用
C.淀粉和纤维素的化学式均可写成(C6H10O5)n,它们互为同分异构体
D.肥皂的有效成分的化学式艾可写成的高级脂肪酸钠
0.010mol/L,列式计算平衡时氢离子的浓度时多少?(已知: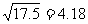 )
)
31.(8分)在25℃,醋酸溶液存在电离平衡CH3COOH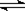 CH3COO-
+ H+
CH3COO-
+ H+
(1)列出醋酸的电离平衡常数的表达式
(2)已知25℃醋酸的电离平衡常数为Ka = 1.75×10-5,若醋酸的起始浓度为
30.(10分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:
①X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是____________。
(2)Z2Y2与X2Y反应的化学方程式是 。
(3)如下图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1后,C(I)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
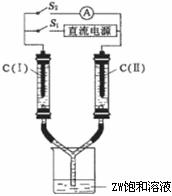
C(Ⅰ)的电极名称是____________(填写正极或负极);
C(Ⅱ)的电极反应式是 。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是 。
29.(10分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)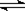 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t ℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是
(a)容器中压强不变 (b)混合气体中 c(CO)不变
(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
28.(10分)化学反应2A+B===2C达到化学平衡时,根据以下条件选择填空.
(1)若升高温度时,C的量增加,此反应_____________.
①是放热反应 ②是吸热反应
③没有显著热量变化 ④化学反应速率加快.
(2)如果A、B、C都是气体,达到平衡时减小压强,那么___________.
①平衡不移动 ②平衡向逆反应方向移动
③平衡向正反应方向移动 ④C的浓度会减小
(3)如果已知B是气体,增大压强时,化学平衡向逆反应方向移动,那么______
①A是气体,C是固体 ②A、B、C都是气体
③A、C都是固体 ④A是固体,C是气体
27.(8分)在250C时,有pH为x的盐酸和pH为y的NaOH溶液,取VxL该盐酸同该NaOH溶液恰好完全中和,需要Vy L的NaOH溶液,问:
(1)若x + y = 14时,Vx/Vy = (填数值)
(2)若x + y = 13时,Vx/Vy = (填数值)
(3)若x + y > 14时,Vx/Vy = (填表达式),且Vx Vy(填"大于""小于"或"等于")
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com