
7.用NA代表阿伏加德罗常数,下列说法正确的是( )
A.22.4LCH4中所含共价键的数目为4NA;
B.在0.5 mol•L-1CH3COOH溶液中CH3COOH分子数小于0.05NA;
C.17g羟基(-OH)所含电子总数为9NA
D.1molCl2通入足量的NaOH溶液中充分反应转移的电子数为2NA;
6.下列有关化学实验的操作或说法中,正确的是( )
A.测定溶液的pH值时,用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较
B.中和滴定实验中,锥形瓶内有少量蒸馏水会造成测定结果偏低
C.苯酚沾在皮肤上应立即用水洗
D.少量金属钠保存在煤油中
29.(14分)2009年10月,两位美国科学家和一位以色列科学家因“对核糖体的结构和功能的研究”而获诺贝尔化学奖。核糖体被誉为生命化学工厂中的工程师,其组成中含有核糖。下面是有关核糖的转化关系图:

已知:①核糖的结构简式为:

②

③

试回答下列问题:
(1)核糖中含氧官能团的名称为 ;
(2)1mol核糖最多与 mol乙酸反应生成酯;
(3)写出反应①的化学方程式 ;
其反应类型是 ;
(4)A的结构简式为 ;
(5)写出B和足量Ag(NH3)2OH溶液反应的化学方程式: ;
(6)某有机物是C的同系物,其相对分子质量为88。其同分异构体满足①能发生水解反应;②发生水解反应后的产物之一能与NaOH溶液反应。则此同分异构体的结构简式为(写4种):
、 、 、 。
28.(17分)
I.如图所示:C、D为多孔惰性电极。

(1)当开关K闭合后,C、D电极周围都会出现的现象是 ;
(2)再从M处注入几滴石蕊试液,溶液先变红,然后变浅,最后褪色。试分析:
①电源A端为 (填“正”或“负”)极
②D处的电极反应式为 ;
③D电极周围石蕊溶液先变红,然后变浅,最后褪色的原因可能是 。
II.已知H2A在水中存在以下电离:H2A H++HA-,HA-
H++HA-,HA- H++A2-。试回答以下问题:
H++A2-。试回答以下问题:
(1)NaHA溶液呈 (填“酸性”、“碱性”、“中性”或“无法确定”),原因是
;
(2)某温度下,向0.1mol·L-1的NaHA溶液中滴入0.1mol·L-1KOH溶液至中性,此时溶液中以下关系一定正确的是 (填字母)
A.c(H+)·c(OH)=1×10-14
B.c(Na+)+c(K+)=2c(A2-)+c(HA-)
C.c(K+)<c(Na+)
D.c(Na+)=0.05mol·L-1
(3)已知常温下:CaA Ca
Ca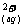 +A
+A ;△H>0,c(Ca2+)·c(A2-)为常数,记作:
;△H>0,c(Ca2+)·c(A2-)为常数,记作:
Ksp=c(Ca2+)·c(A2-)。试回答:
①温度升高时,Ksp (填“增大”、“减小”或“不变”,下同)
②滴加少量浓盐酸,c(Ca2+) ,原因是
(用文字和离子方程式说明)。
27.(14分)某化学兴趣小组欲选用下列装置和药品制取纯净乙炔并进行有关乙炔性质的探究,试回答下列问题。
I.(1)A中制取乙炔的化学反应方程式为 ;
(2)制乙炔时,旋开分液漏斗,使水缓慢滴下的原因是 ;
(3)用电石制的乙炔中常含有H2S、PH3等杂质,除去杂质应选用 (填序号,下同)装置,气体应从 进;干燥乙炔最好选用 装置;C中通入含杂质的乙炔后有Cu3P沉淀、H3PO4等生成,该反应的化学方程式为 。
II.为了探究乙炔与HBr发生加成反应的有关产物,进行以下实验:

(1)操作b的名称是 ;
(2)有机混合物I可能含有的物质是 (写结构简式);
(3)最后得到的有机混合物II中含两种有机物,其中一种能发生银镜反应且每1mol该有机物反应最多得到2molAg,其结构简式为 ;
26.(15分)A、B、C、D、E、F是原子序数依次增大的六种短周期元素。A和E、D和F分别同主族,D的最外层电子数是E的最外层电子数的6倍,B是形成化合物种类最多的元素。
(1)能表示F元素中质子数和中子数相等的同位素符号是 ;
(2)D在周期表中的位置是 ;
(3)在一定条件下E和F可以形成化合物E2F2,其电子式为 ;
该物质在固态时的晶体类型是 ;
(4)B、C、D的氢化物的稳定性由大到小的顺序为 (用化学式表示);C的氢化物和它的最高价氧化物对应的水化物反应生成Z,Z的水溶液呈
(填“酸”“碱”或“中”)性,用离子方程式表示其原因为 ;
(5)元素A、D组成的单质A2、D2在以CH3COONa溶液为电解液,多孔碳棒为两极时可构成原电池。
①负极的电池反应为 ;
②随电池放电,溶液中的c(Na+) (填“增大”、“减小”或“不变”)。
13.CO和H2是有机合成的重要原料。某化学小组拟用下列装置制取合成气CO、H2。将xmolO2和一定量CH4在燃烧室中不完全燃烧,产生的物质完全进入催化室与CH4恰好完全反应,生成CO和H2。则从催化室中出来的H2为 ( )

A.xmol B.3xmol C.4xmol D.5xmol
第Ⅱ卷(非选择题)
12.在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g) 2HBr(g);△H<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法不正确的是 ( )
2HBr(g);△H<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法不正确的是 ( )
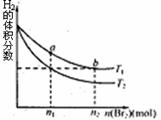
A.由图可知:T1>T2
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
11.已知:①
②
下列说法正确的是 ( )
A.通常状况下,氢气的燃烧热为241.8kJ·mol-1
B.由①可知,1molCO(g)和 molO2(g)反应生成1molCO2(g),放出283.0kJ的热量
molO2(g)反应生成1molCO2(g),放出283.0kJ的热量
C.可用下图表示2CO2(g)====2CO(g)+O2(g)反应过程中的能量变化关系

D.分解1molH2O(g),其反应热为-241.8kJ
10.下列说法正确是 ( )
A.化学变化中一定有化学键形成
B.分子晶体的熔沸点很低,常温下均呈液态或气态
C.强电解质都易溶于水且完全电离,其水溶液都易导电
D.只由非金属元素形成的化合物不可能是离子化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com