
13.若C2H2Cl2有三种同分异构体,则C4H8有多少种烯烃同分异构体( )
A.2 B.3 C.4 D.5
第Ⅱ卷 非选择题
12.下列实验用错试剂的是( )
A.加浓硫酸蒸馏浓缩硝酸 B.用氨水清洗试管内壁附着的银
C.用碱石灰吸收氨气中的水蒸气 D.用热碱溶液除去待镀铁件表面的油污
11.等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是( )
A.6 mol·L-1KOH溶液 B.18 mol·L-1H2SO4溶液
C.2mol·L-1H2SO4溶液 D.3 mol·L-1HNO3溶液
10.下列叙述正确的是( )
A.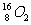 和
和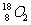 互为同位素,性质相似
互为同位素,性质相似
B.常温下,pH=1的水溶液中Na+、NO3- 、HCO3- 、Fe2+可以大量共存
C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
D.镁合金的硬度和强度均高于纯镁
9.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.反应速率:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
8.锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为( )
A.2mol B.1 mol C.0.5mol D.0.25mol
7.研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:①SO2+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2 ,NO2在上述过程中的作用,与H2SO4在下列变化中的作用相似的是( )
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶
B.硫化氢通入浓H2SO4中
C.浓H2SO4滴入氯化钠固体上,并加热
D.加入少量H2SO4使乙酸乙酯水解
6.将空气中氮气转化为氮的化合物的过程称为固氮。下面不能实现固氮的是( )
A.闪电 B.氨催化氧化制一氧化氮
B.氨催化氧化制一氧化氮
C.根瘤菌 D.合成氨
28.(16分)2007年度诺贝尔化学奖获得者格哈德·埃特尔建立了合成氨反应机理,T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ·mol-1。(注:图中“吸”表示在催化剂表面的吸附)请回答下列问题:
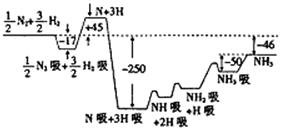
(1)合成氨反应的机理为
① ;
②N:  N2吸
N2吸  2N
2N  2N吸
2N吸
③ ;
④NH吸+H吸  NH2吸;
NH2吸;
⑤NH2吸+H吸  NH3吸
NH3吸  NH3。
NH3。
(2)T=673K时,合成氨反应的热化学方程为 。
(3)液氨与水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为:
2NH3
 NH+4+NH-2(某温度下其离子积常数为10-20)。液氨中的pNH4与水中的pH类似,则该温度下液氨的pNH4=
。
NH+4+NH-2(某温度下其离子积常数为10-20)。液氨中的pNH4与水中的pH类似,则该温度下液氨的pNH4=
。
(4)盐酸肼(N2H4Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式 。
27.(14分)实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如下图所示:
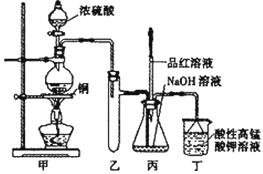
请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,有人认为还有一定量的H2SO4剩余,原因是
,在不增加浓H2SO4的前提下,若使剩余铜片溶解可再加入 (填写两种属于不同类别的物质)。
(2)向反应后的溶液中加入足量的CuO,使剩余的H2SO4全部转化为CuSO4,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·XH2O)某小组同学采用加热法测定该晶体里结晶水X的值;
①在他们的实验操作中至少称量 次。
②下面是其中一次实验的数据
|
坩埚质量 |
坩埚与晶体总质量 |
加热后坩埚与固体总质量 |
|
11.7g |
22.7g |
18.6g |
根据上表数据计算判断x的实测值比理论值(x=5) (填“偏大”或“偏小”)。
(3)装置乙的作用是: ;
(4)下列说法正确的是: (填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
f.此装置换上其它药品后,不能制取和收集少量纯净的氯气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com