

6.下列有关二氧化硫的说法中正确的是 ( )
A.二氧化硫能漂白某些物质,说明它具有还原性
B.二氧化硫的水溶液能使紫色石蕊试液变红,说明它没有漂白性
C.将足量二氧化硫通入酸性高锰酸钾试液中紫色褪去,说明二氧化硫具有还原性
D.因二氧化硫具有强还原性,所以实验室不能用浓硫酸干燥二氧化硫
5.下列说法中正确的是 ( )
A.MgSO4晶体中只存在共价键
B.明矾净水的原理是电离出的硫酸根离子与水中的钙离子发生沉淀
C.雾是气溶胶,在阳光下可观察到丁达尔效应
D.玻璃是氧化物,成分可表示为Na2O·CaO·6SiO2
4.能实现下列物质间直接转化的元素是 ( )
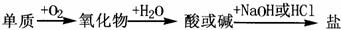
A.硅 B.硫 C.铜 D.铁
3.25℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断正确的是( )
A.前者仅存在水解平衡,不存在电离平衡
B.两溶液中存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)前者增大后者减小
2.用浓氯化铵、磷酸铵溶液处理过的舞台幕布不易着火。其原因是 ( )
①幕布的着火点升高
②幕布的质量增加
③氯化铵、磷酸铵分解吸收热量,降低了温度
④氯化铵、磷酸铵分解产生的气体隔绝了空气
A.①② B.③④ C.③④ D.②④
1.“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫:这与高中化学中“焰色反应”知识相关。下列说法中正确的是 ( )
A.非金属单质燃烧时火焰均为无色
B.只有金属单质灼烧时火焰才有颜色
C.用Pt做钾的焰色反应时不需要透过蓝色钴玻璃观察
D.NaCl与Na2CO3灼烧时火焰颜色均为黄色
30.(16分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
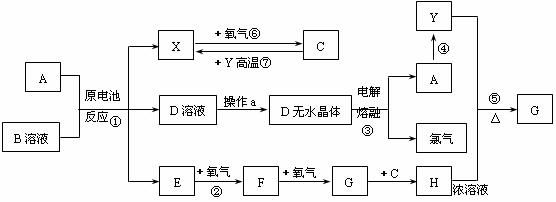
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为 。
(6)C+Y→X反应的化学方程式为 。
(7)写出D的形成过程 。
(8)写出H的两种重要用途 。
29.(12分)甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
①丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,该反应的化学方程式为: 。
②乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途: 。
③在一定条件下,甲与O2反应的化学方程式是 。
④丁的元素符号是 ,它的原子结构示意图为 。
⑤在一定条件下,甲与H2反应生成1mol生成物放出的热量为46.2kJ,写出该反应的热化学方程式:_____________________________。
28.(14分)(1)(6分) 标准状况下336L的NH3溶于1L水中,则所得溶液的溶质质量分数为 ,若该溶液的密度为a g/mL,则其物质的量浓度为 (用含a的式子表示),将上述氨水全部转化为NH4Cl,需要4mol/L的盐酸的体积是 。
(2)(8分)有A、B、C、D、E五种微粒,它们都含有10个电子。通常状况下,微粒A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色胶状沉淀。请回答:
①用化学符号填空:
B的结构式 ,C的电子式 。
②写出A、B、E三种微粒反应的离子方程式: 。
③写出白色胶状沉淀与氢氧化钠溶液反应的离子方程式为 。
27.(18分)类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生成FeCl3,当铁粉过量时产物是FeCl2,为验证该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的Cl2中点燃,取其表面生成物并分别编号为A、B,然后通过实验确定其成分。探究过程如下:
(1)提出假设:A是FeCl3,B是FeCl2
(2)设计实验方案:分别取A、B的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格:
|
实验方法 |
实验现象 |
结论 |
|
分别向A、B溶液中加KSCN溶液 |
|
固体物质中有FeCl3 |
|
分别向KMnO4溶液中加适量A、B溶液 |
KMnO4溶液颜色无明显变化 |
固体物质中不含______ |
(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式:
___________________________________________________。
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是 ____________(填写序号)
A.将A溶液滴入淀粉碘化钾溶液中,可得到蓝色液体,该液体能产生丁达尔现象
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到FeCl3固体
(5)FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有FeCl3 、FeCl2、CuCl2,其离子方程式为_________________________。某研究性学习小组的同学们设计了两种从废液中回收Cu的方案:
方案1:向废液中加入过量的铁粉,充分反应后,过滤,在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜。该方案中涉及的四种阳离子的氧化性由强到弱的顺序为:
______________________________________。
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解,当观察到阴极上少量气泡产生时,即停止电解,这时要回收的Cu已全部析出,该方案中铜作________极。所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出) __________________________________________。
方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:
___________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com