
(二)验证NO的还原性;探究工业生产硝酸的原理
(1)停止通入NO后关闭K1、K3,打开K2,从导管b缓缓通入O2,写出通入O2过程中发生的化学反应方程式____________________;
(2)继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直至广口瓶①中刚好充满液体.
Ⅰ.当通入氧气的体积为V/2时,则广口瓶①的气体体积为__________;
Ⅱ.当广口瓶①的气体体积为V/2,则通入氧气的体积可能为__________.
30.(14分)已知A为中学化学中的一种盐,B、C为日常生活中常见的金属.通常条件下D、G为无色无味气体。已知用惰性电极电解A溶液一段时间后,产物只有C、D和E的稀溶液.各物质之间的转化关系如下图(部分反应产物已略去). 
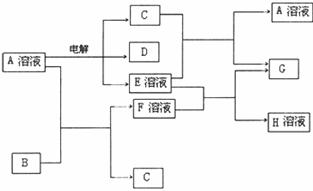
请回答下列问题:
(1)A的化学式为____________________.
(2)A溶液与Na2O2反应的总化学方程式为____________________.
(3)E的稀溶液与F溶液反应的离子方程式为____________________.
(4)电解100mL盐A的溶液一段时间后,断开电路,取出电极,测得所得到的气体D在标准状况下的体积为5.6mL,则电解后溶液的pH为__________.(假设溶液体积不变)
(5)若向100mL盐A的溶液中加入10g金属单质B的粉末,充分搅拌后,过滤,烘干得10.16g固体C。则滤液中溶质的物质的量浓度为__________.(假设溶液体积不变)
(一)向广口瓶①中通入NO并测定NO的体积
(1)通入NO前,向广口瓶①中加入水,让水充满广口瓶①,且调节滴定管中液面与①相平并记录滴定管的刻度。
(2)从导管a通入一定量的NO并准确测定通入NO的体积的主要操作:______;计算出通入的NO的体积为VmL(V<50mL).
6.下列有关实验描叙中,正确的是( )
A.检验溴乙烷中的溴元素:在溴乙烷中滴入氢氧化钾溶液加热后,用稀硝酸酸化再滴加硝酸银溶液
B.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
C.配制一定物质的量浓度溶液时,用量筒量取浓溶液时仰视读数,所得溶液的浓度偏低
D.证明CH2=CHCH2CHO中一定有碳碳不饱和键,滴入KMnO4酸性溶液,看紫红色是否褪去
7.下列各项内容中,排列顺序正确的是 ( )
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②相同pH的下列溶液中NH4+的浓度:(NH4)2SO4>NH4Cl>NH4HSO4
③氢化物的沸点:H2Se>H2S>H2O
④给出质子的能力:CH3COOH>NaHCO3>Al(OH)3
A.①③ B.①④ C.①② D.③④
8.用NA表示阿伏加德罗常数的值.下列叙述正确的是 ( )
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
B.常温下,46g分子式为C2H6O的物质中一定含有极性键为7NA,非极性键为NA
C.125mL 16mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于NA
D.标准状况下,体积为22.4L NO2、N2O4的混合气体,升温至常温,则混合气体分子数为NA
9.如图为某有机物的结构简式。已知酯类在铜铬氧化物(CuO·CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:在铜铬氧化物催化下,R1COOR2+2H2→R1CH2OH+R2OH,关于该化合物的下列说法中,正确的是 ( )
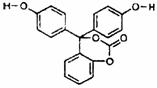
A.该有机物的化学式为C20H14O5,该有机物可以属于酯类、酚类、醚类
B.该有机物可以与浓溴水发生加成反应
C.与足量氢氧化钠溶液充分反应,1mol该有机物最多可以与5mol NaOH反应,所得产物中有醇类物质
D.1mol该有机物在铜铬氧化物催化下仅能与2mol氢气发生反应
10.下列叙述正确的是 ( )
A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42-
B.常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中,c(OH-)/c(H+)=1012,将这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为:
c(B+)>c(OH-)>c(H+)>c(A-)
C.过量SO2通入到Ba(NO3)2溶液中,正确的离子反应方程式为:
3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+
D.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb
11.北京大学教授,著名的化学家和教育家徐光宪教授,是我国理论化学和稀土化学的奠基人之一,2008年获得“国家最高科学技术奖”,以表彰他在稀土理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应并产生气体。已知:铈常见的化合价为+3和+4,且Ce4++Fe2+=Ce3++Fe3+。下列说法正确的是 ( )
A.用Pt作阴极,Fe作阳极,电解熔融CeO2,可在阳极获得铈
B.将少量的碘化亚铁溶液滴加到Ce(SO4)2溶液中,其离子方程式为:
Ce4++Fe2+=Ce3++Fe3+
C.金属铈着火,可采用普通的泡沫灭火器灭火
D.金属铈可浸于煤油中保存,储存在阴凉、通风的地方,要远离火种和热源
12.用惰性电极电解一定质量的某浓度的NaCl溶液,一段时间后停止电解.此时若加入100g 36.5%的浓盐酸,所得溶液正好与原溶液完全相同,则下列说法正确的是 ( )
A.电解过程中,两极所得到的气体,在相同的条件下体积相等
B.电解过程中,在相同的条件下,阳极所得到的气体的体积比阴极的大
C.电解过程中转移电子的物质的量约为8mol
D.原某浓度的NaCl溶液中溶有117g NaCl
13.将由FeSO4、Ba(OH)2、AlCl3三种固体组成的混合物溶于足量的水中,用玻棒搅拌,充分溶解,一段时间后,向稳定的混合物溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的物质的量关系如图所示。下列有关判断不正确的是 ( )
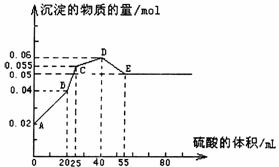
A.AB段发生反应的离子方程式为:Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O
B.D点表示的溶液呈酸性
C.C点表示的沉淀的化学式为Al(OH)3、BaSO4、Fe(OH)2
D.混合物中FeSO4和AlCl3的物质的量相等
第Ⅱ卷(非选择题)
27.(14分)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)1mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物发生反应,完全反应后消耗后者的物质的量为__________.
(2)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为__________.
(3)单质B的燃烧热a kJ/mol,由B、C二种元素组成的化合物BC14g完全燃烧放出b kJ热量,写出单质B和单质C反应生成BC的热化学方程式:____________________.
(4)工业上在高温的条件下,可以用A2C和BC反应制取单质A2.在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1mol A2C和1mol BC、2mol A2C和2mol BC.一定条件下,充分反应后分别达到平衡(两容器温度相等)。下列说法正确的是__________
A.达到平衡所需要的时间:Ⅰ>Ⅱ
B.达到平衡后A2C的转化率:Ⅰ=Ⅱ
C.达到平衡后BC的物质的量:Ⅰ>Ⅱ
D.达到平衡后A2的体积分数:Ⅰ<Ⅱ
E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ
F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极反应式是____________________.
28.(16分)某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色:J分子内有两个互为对位的取代基.在一定条件下有如下的转化关系:(无机物略去)
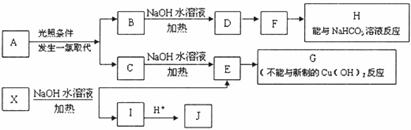
(1)属于芳香烃类的A的同分异构体中,其沸点的大小关系为____________________.(不包括A,用结构简式表示)
(2)J中所含的含氧官能团的名称为____________________.
(3)E与H反应的化学方程式是____________________;反应类型是__________.
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的名称是__________.
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式.①与FeCl3溶液作用显紫色;②与新制Cu(OH)2悬浊液作用产生红色沉淀;③苯环上的一卤代物有2种。_______________________________________
29.(16分)某活动小组利用下图装置验证NO的还原性及探究工业生产硝酸的原理。
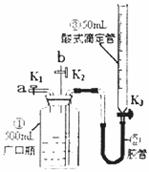
如何检查该装置气密性____________________.
23.某学生用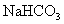 和
和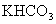 组成的某化合物进行试验,测得如下数据(盐酸的物质的量浓度相等):
组成的某化合物进行试验,测得如下数据(盐酸的物质的量浓度相等):
|
实验编号 |
① |
② |
③ |
|
盐酸体积 |
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
|
m(混合物) |
9.2g |
16.56 g |
27.6 g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
根据表中数据试计算:
(1)盐酸的物质的量浓度。
(2)混合物中NaHCO3的质量分数。
22.(12分)三草酸合铁酸钾晶体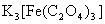 ·
·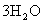 可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸(A)、1.0 mol·L-1HNO3(B)、1.0 mol·L-1盐酸(C)、1.0 mol·L-1 NaOH(D)、3%H2O2(E)、0.1mol·L-1KI(F)、0.1 mol·L-1CuSO4(G)、20%KSCN(H)、澄清石灰水(I)、氧化铜(J)、蒸馏水(K)、澄清石灰水(L)。
(1)要验证产物中有CO2、CO存在的试剂________应选(按先后顺序把所选试剂的代号字母填入空格内。)
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有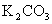 。验证固体产物中
。验证固体产物中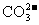 的方法是
。
的方法是
。
(3)固体产物中铁元素存在形式的探究。
固体产物中铁元素存在形式的探究。
①提出合理假设;假设1:只有Fe;
假设2:只有FeO;
假设3:FeO和Fe。
②设计实验方案证明假设
步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振汤便碳酸钾完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体。
步骤2:将步骤1中的不溶固体产物加入1.0mol·L-1盐酸中。
步骤3:将步骤1中的不溶固体产物加入足量的0.1 mol·L-1CuSO4中充分反应后过滤、洗涤后,将沉淀物溶于1.0 mol·L-1盐酸,再加入20%KSCN,最后加入3%H2O2。
③实验过程(填写下表的空格)
|
实验步骤 |
预期现象与结论 |
|
步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使碳酸钾完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体 |
固体产物部分溶解 |
|
步骤2:向试管中加入适量硫酸铜溶液,再加入少量将步骤1中的不溶固体,充分振荡 |
(1)若蓝色溶液颜色及加入的不溶固体无明显变化,则假设
成立。 (2)若蓝色溶液颜色明显改变,且有暗红色固体生成.则证明有 存在。 |
|
步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色。取少量固体于试管中,滴加过量HCl,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN |
结合步骤2中的(2): (1)若溶液基本无色,则假设(1)成立 (2)若 ,则假设 成立 |
21.(10分)通常状况下,X、Y和Z是由两种短周期元素形成的三种气态单质,X的水溶液呈淡黄绿色,反应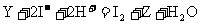 常作为Y的鉴定反应。
常作为Y的鉴定反应。
(1)X与Z的相互关系是: 。
(2)二氧化硫通入X的溶液,写出反应的离子方程式: 。
(3)举出实例说明硫单质的氧化性比X的氧化性弱(用化学方程式表示,反应类型为:置换反应)。 。
(4)气体(CN)2与x化学性质相似,也能与H2反应生成HCN(其水溶液是一种弱酸)。
用离子方程式表示0.1mol/L的KCN溶液显碱性的原因: 。离子浓度大小的顺序是(由大到小) 。
20.铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
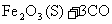 =====
=====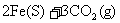
①反应的平衡常数表达式为:K= 。
②该温度下,在2L盛有Fe2O,粉末的密闭容器中通入CO气体,则10min内CO2的平均反应速率为0.015mol/(L·min),10min后生成了单质铁 g。
(2)可用上述反应中某种物理量来说明该反应已达到平衡状态的是 。
A.CO的生成速率与CO2的生成速率相等
B.CO生成速率与CO2消耗速率相等
C.CO的质量不变
D.体系的压强不再发生变化
E.气体密度不再变化
(3)写出氢氧化铝在水中发生酸式电离的电离方程式: 。
欲使上述体系中Al3+浓度增加,可加入的物质是 。
A.NaOH B.HCl C.NH3 D.NaHSO4
19.(14分)下表为元素周期表的一部分,请参照①~⑧在表中的位置,用化学用语回答下列问题:
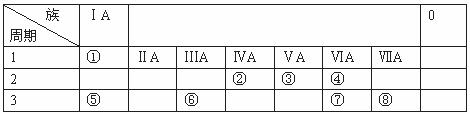
(1)③和④的第一电离能大小 。
(2)④、⑤、⑥的离子半径由大到小的顺序为 。
(3)②、⑦、⑧的最高价氧化物的水化物的酸性由强到弱的顺序是 。
(4)写出①、④、⑧按1:1:1形成的化合物的电子式: 。
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
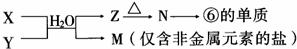
X溶液与Y溶液反应的离子方程式为 ,N(电解其熔融物)→⑥的单质的化学方程式为 。常温下,为使0.1 mol/L.M溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至 。
18.市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传到Li+的高分子材料。这种锂离子电池的电池反应为:Li+2Li0.35NiO2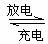 2Li0.85NiO2。下列说法正确的是( )
2Li0.85NiO2。下列说法正确的是( )
A.放电时,负极的电极反应式为:
B.充电时,Li发生氧化反应
C.该电池不能用水溶液作为电解质
D.放电过程中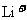 向负极移动
向负极移动
第Ⅱ卷(非选择题 共56分)
17.关于下列三种有机物的说法正确的是 ( )
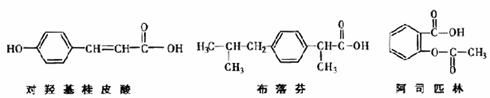
A.三种有机物均有苯环能与浓溴水发生加成反应
B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C.将等物质的量的三种物质加入氢氧化钠溶液中,阿司匹林消耗氢氧化钠最多
D.使用FeCl3溶液和稀硫酸不能鉴别出这三种有机物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com