

1.空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施中,不利于“蓝天工程”建设的是
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防治扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的使用量
30.(6分)将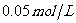 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得混合溶液的pH=12。用上述NaOH溶液滴定pH=3的某一元弱酸溶液20mL,达到终点时,消耗NaOH溶液12.5mL。则
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得混合溶液的pH=12。用上述NaOH溶液滴定pH=3的某一元弱酸溶液20mL,达到终点时,消耗NaOH溶液12.5mL。则
(1)NaOH溶液的物质的量浓度为_____________;
(2)此一元弱酸的物质的量浓度为_____________;
(3)此一无弱酸的电离度为_____________。
29.(7分)向50mL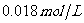 的AgNO3溶液中,加入50mL
的AgNO3溶液中,加入50mL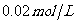 的盐酸,已知该温度条件下
的盐酸,已知该温度条件下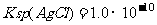 ,则:
,则:
(1)此时能否生成沉淀__________(填“能”或“否”),原因是______________________;
(2)沉淀生成后溶液中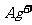 物质的量浓度为_______________;
物质的量浓度为_______________;
(3)沉淀生成后溶液的pH值是______________。
28.(9分)丁烷的分子结构可简写成键线式结构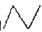 ,有机物A的键线式结构为
,有机物A的键线式结构为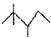 ,有机物B与等物质的量的H2发生加成反应可得到有机物A。则:
,有机物B与等物质的量的H2发生加成反应可得到有机物A。则:
(1)有机物A的分子为_______________________________________。
(2)用系统命名法命名有机物A,其名称为____________,A与氯气光照生成的一氯代物有_________种。
(3)有机物B可能的结构简式为:____________、____________、____________。
27.(6分)某芳香族化合物A的分子式为C7H6O2,溶NaHCO3,水溶液,将此溶液加热,能用石蕊试纸检验出有酸性气体产生。
(1)写出化合物A的结构简式:_______________________________________;
(2)依题意写出化学反应方程式:_______________________________________;
(3)写出A属于芳香族化合物的同分异构体中任意一个的结构简式_____________________。
26.(12分)DIS系统即数字化信息系统,它由传感器、数据采集器和计算机组成,某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力求判断滴定终点,实验步骤如下:
(1)用____________(填仪器名称)量取10.00mL的食用白醋,在____________(填仪器名称)中用水稀释后转移到100mL____________(填仪器名称)中定容,然后将稀释后的溶液倒入试剂瓶中。
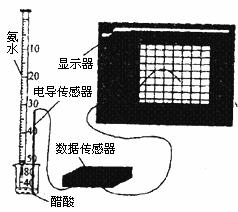
(2)量取20.00mL的上述溶液倒入烧杯中,连接好DIS系统(如上图),向烧杯中滴加浓度为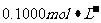 的氨水,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线(见下图)。
的氨水,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线(见下图)。
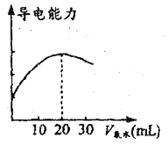
①用滴定管盛氨水前,滴定管要用___________润洗2-3遍,润洗的目的是___________,若没有润洗滴定管,则会使测定结果___________(填偏高、偏低或无影响)
②氨水与醋酸反应的离子方程式是______________________;
③食用白醋中醋酸的物质的量浓度是______________________。
25.(8分)
(1)NaHCO3的水溶液呈________(填“酸”、“中”、“碱”性),原因是(用离子方程式表示):_____________________________________。
(2)实验室中配制FeCl3溶液的方法是___________________________________。如果把FeCl3溶液加热蒸干,灼烧,最后得到的主要固体产物是__________,原因是(用简要的文字和化学方样式来说明):_______________________________。
24.(6分)已知25℃时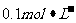 醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了
醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了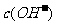 ,因而溶液的pH增大;乙同学认醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使
,因而溶液的pH增大;乙同学认醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使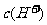 减小,因而pH增大。
减小,因而pH增大。
(1)你认为上述解释中_____________(“甲”或“乙”)正确。
(2)为了验证上述哪种解释正确,继续做如下实验:向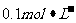 的醋酸溶液中加入少量的下列物质中的。(填写编号),然后测定溶液的pH。
的醋酸溶液中加入少量的下列物质中的。(填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
(3)若____________(填“甲”或“乙”)的解释正确,溶液的pH应__________(填“增大”、“减少”或“不变”)。
23.(10分)T℃时,有甲、乙两个密闭容器,甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中加入6mo1A和3mo1B,发生反应如下: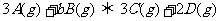 ;
;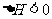 ,4min甲容器内的反应恰好达到平衡,A的浓度为
,4min甲容器内的反应恰好达到平衡,A的浓度为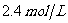 ,B的浓度为
,B的浓度为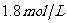 。根据题给信息回答下列问题:
。根据题给信息回答下列问题:
(1)甲容器中反应的平均速率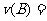 __________。化学方程式中计量数
__________。化学方程式中计量数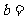 ____________。
____________。
(2)乙容器中反应达到平衡所需时间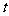 ____4min(填“大于”、“小于”或“等于”),原因是____________________________________________。
____4min(填“大于”、“小于”或“等于”),原因是____________________________________________。
(3)T℃时,在另一个体积与甲相同的丙容器中,为了达到平衡B的浓度仍然为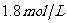 ,起始时,向丙容器中加入C、D的物质的量分别为3mol、2mol,则还需加入A、B的物质的量分别是_________、____________。
,起始时,向丙容器中加入C、D的物质的量分别为3mol、2mol,则还需加入A、B的物质的量分别是_________、____________。
(4)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是__________
A.保持温度不变,增大甲容器的体积至2L
B.保持容器体积不为,使甲容器升高温度
C.保持容器压强和温度都不变,向甲中加入一定量A气体
D.保持容器压强和温度都不变,向甲中加入一定量B气体
22.向Cr2(SO4)3的水溶液中加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多;但当pH>13时,沉淀消失,出现亮绿色的亚铬酸根离子(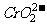 )。其平衡关系如下:
)。其平衡关系如下:
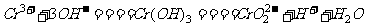
(紫色) (灰绿色) (亮绿色)
向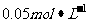 Cr2(SO4)3溶液50mL中,加入
Cr2(SO4)3溶液50mL中,加入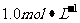 NaOH溶液50m1,充分反应后,溶液中可观察到的现象是
NaOH溶液50m1,充分反应后,溶液中可观察到的现象是
A.溶液为紫色 B.溶液中有灰绿色沉淀
C.溶液为亮绿色 D.无法判断
第Ⅱ卷(非选择题,共64分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com