
7.核内质子数不同,核外电子数相同的两种微粒,它们可能是
A.不同元素的原子 B.同种元素的原子和离子
C.不同元素的离子 D.同种元素的两种离子
6.下列有关物质的分类或归类正确的是 ①混合物:漂白粉、水玻璃、水银 ②化合物:CaCl2、烧碱、液氯 ③电解质:氧化钠、硫酸钡、次氯酸 ④同位素:126C、136C、146C
A.①③④ B.③④ C.②③④ D.②④
5.下列说法中正确的是
A.pH=7的溶液一定呈中性
B.稀溶液中c(H+)·c(OH-)=KW,任何条件下KW都保持不变
C.向水中加入硫酸氢钠,促进水的电离
D.温度升高,水的电离程度增大
4.下列反应中属于氧化还原反应,且反应物总能量低于生成物总能量的是
A.镁条与稀盐酸反应 B.灼热的碳与CO2反应
C.CO在空气中的燃烧反应 D.碱式碳酸铜的分解反应
3.海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是
A.海水中含有镁元素,只需经过物理变化就可以得到镁单质
B.海水晒盐的过程中发生了吸热反应
C.从海水中可得到NaCl,电解饱和NaCl溶液可以制得Cl2
D.利用潮汐发电是将化学能转化为电能
2.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的相对分子质量大于乙的相对分子质量,下列说法正确的是
A.甲的分子数比乙的分子数多 B.甲的物质的量比乙的物质的量少
C.甲的体积与乙的体积相等 D.甲的摩尔质量比乙的摩尔质量小
1.化学与生活、社会密切相关。下列说法不正确的是
A.回收并合理处理聚乙烯塑料废物
B.pH在5.6-7.0之间的降水通常称为酸雨
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.燃煤时加入适量石灰石,可减少废气中SO2的量
31.(8分)某研究性学习小组为了变废为宝对工业废水进行了综合研究:
首先以富含硫酸亚铁的工业废液为原料回收硫酸亚铁晶体,然后用上述制备硫酸亚铁晶体处理富含Cr2O72-废水,制备磁性材料Cr0.5Fe1.5FeO4。步骤如下:
①向废液中加入足量铁屑和适量20%-30%的稀硫酸,在50℃ -80℃ 水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集产品。
②向含Cr2O72-的酸性废水中加入过量FeSO4·7H2O。
(Cr2O72-+ 6Fe2++14H+=2Cr3+ + 6Fe3++7H2O)
③向反应后的溶液中加入NaOH溶液至pH为9,过滤,将滤渣焙烧得到磁性材料
Cr0.5Fe1.5FeO4(Cr的化合价为+3)。
请回答下列问题:
(1)第①步中加足量铁屑的目的是(用离子方程式表示) ,
运用化学平衡原理简述20%-30%的稀硫酸的作用 。
(2)第③步中用pH试纸测定溶液pH的操作是
 。
。
(3) 第③步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
。
第③步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
。
(4)Cr0.5Fe1.5FeO4 中,Fe3+与Fe2+的物质的量之比为
。
中,Fe3+与Fe2+的物质的量之比为
。
30.(16分)某兴趣小组研究锌与不同浓度硫酸的反应,对所产生的气体进行如下研究。
(1)锌与浓硫酸反应产生SO2(Zn+2H2SO4(浓)= ZnSO4+SO2↑+2H2O),该小组同学设计了两个实验,分别证明了二氧化硫的氧化性和还原性(实验试剂及用品自选)。请将他们的实验方法和实验现象填入下表:
|
实 验 内 容 |
实 验 方 法 |
实 验 现 象 |
|
验证氧化性 |
|
|
|
验证还原性 |
|
|
(2)锌与稀硫酸反应产生H2,该小组同学将H2通入灼热的氧化铜来验证氢气的还原性。如图是该组同学设计的发生装置,你认为应该选择的装置为 ,反应开始前,必须进行的操作是检查装置的气密性和 ;反应进行时,应先 再 ;实验过程中,观察到试管中固体颜色变化为 。

(3)该小组同学取足量锌粒与2mol浓硫酸充分反应后,测得SO2和H2的总体积(标况下)为26.88L,放出的热量共为a kJ。SO2和H2的物质的量比为 ,已知锌与稀硫酸反应生成1molH2时放出热量为b kJ,则锌与浓硫酸反应生成1molSO2时放出的热量为 。
[选做部分]
29.(12分)某研究小组用电解法从粗铜(含少量锌、铁、银、金)中回收铜,并对阳极泥和电解液进行了研究,请你参与他们的研究活动。
(1)活动一:电解精制铜。
电解时,以粗铜为 极, 为电解液,电解一段时间后电解液的浓度 (选填:增大、减小、不变),阴极上的电极反应为 。
(2)活动二:电解完成后,该小组同学按以下流程对电解液进行处理。
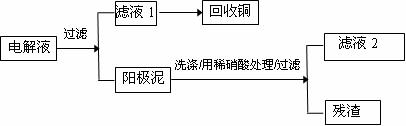
①滤液1中含有的金属阳离子有 ,向滤液1中加入 可得到金属铜。
②写出阳极泥用稀硝酸处理时发生反应的离子方程式 。
(3)活动三:对残渣的研究。残渣含有极少量的黄金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
|
序号 |
反应 |
平衡常数 |
|
1 |
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O |
< 1 |
|
2 |
Au3+ +
4Cl- = AuCl4- |
>1 |
已知金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com