
3.NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为一类物质,下列分类标准不正确的是
A.钠的化合物 B.可与硝酸反应 C.可溶于水 D.电解质
2.在下列三个实验中:①配制一定物质的量浓度的溶液 ②蒸发 ③过滤,均要用到的仪器是
A.试管 B.胶头滴管 C.玻璃棒 D.漏斗
1.日常生活中的“加碘食盐”、“铁强化酱油”、“含氟牙膏”等商品。其中的碘、铁、氟应理解为
A.单质 B.元素 C.分子
D.氧化物
B.元素 C.分子
D.氧化物
24.(10分)在以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
Ⅰ:C+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
Ⅱ:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)从反应混合物中分离出H2的方法通常是以碱液洗气,根据该合成氨工厂的实际分析,最好选用下列 作为吸收剂,理由是 。
A.氢氧化钠溶液 B.氨水 C.石灰水
(2)T℃时,在一定体积的容器中,通入一定量CO(g)和H2O(g),发生反应Ⅱ。保持温度不变,各物质浓度随时间变化如下表:
T℃时物质的浓度(mol·L-1)变化
|
时间/min |
CO(g) |
H2O(g) |
CO2(g) |
H2(g) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
0.100 |
0.200 |
0.100 |
0.100 |
|
4 |
0.100 |
0.200 |
0.100 |
0.100 |
|
5 |
0.116 |
0.216 |
0.084 |
c1 |
|
6 |
0.096 |
0.266 |
0.104 |
c2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。第4~5min之间,改变的条件是 。T℃时该化学反应的平衡常数是 。
(3)800℃时,反应Ⅱ的平衡常数为1,按下表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D、E)。
|
|
A |
B |
C |
D |
E |
|
n(CO2) |
3 |
1 |
0 |
1 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
2 |
|
n(CO) |
1 |
2 |
3 |
0.5 |
3 |
|
n(H2O) |
5 |
2 |
3 |
2 |
1 |
(4)500℃时,反应Ⅱ的平衡常数为9,则该反应正向是 反应(填“放热”或“吸热”)。反应开始时CO(g)和H2O(g)的浓度都是0.1 mol·L-1,则CO在此条件下的转化率为 。
23.(10分)下面是小华在复习《物质在水溶液中的行为》时对主干知识和典型题目的整理。
(1)外界条件对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下表所示:
|
醋酸浓度(mol·L-1) |
0.0010 |
0.0100 |
0.0200 |
0.1000 |
0.2000 |
|
pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
根据表中的数据,可以得出以下结论:第一,醋酸是弱电解质。你认为得出此结论的依据是 ;第二,随醋酸浓度的减小,醋酸的电离程度 (选填:增大、减小、不变)。
(2)盐类的水解反应NaClO和KAl(SO4)2都是重要的化工产品,均可以用于造纸业。NaClO溶液pH大于7,原因是 (用离子方程式表示);1 mol·L-1 KAl(SO4)2溶液中离子浓度由大到小的顺序是 。
(3)沉淀溶解平衡
锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。水垢中的CaSO4不能直接用酸除去,需要加入碳酸钠溶液,使其转化为易溶于盐酸的CaCO3除去。CaSO4能转化为CaCO3 的原因是(用文字叙述) 。
(4)标定醋酸溶液的浓度
为标定某醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如表所示:
|
实验序号 |
1 |
2 |
3 |
4 |
|
消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.10 |
19.95 |
醋酸溶液的准确浓度为 。
22.(9分)A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,其中只有一种是金属元素,A是周期表中原子半径最小的元素,B元素原子的最外层电子数是次外层电子数的两倍,C元素原子最外层电子数是D元素原子最外层电子数的一半。E也是短周期元素,与D同主族。
(1)C和E的元素符号分别为 、 。
(2)C、D两元素原子半径的大小关系是C D(选填:>、<),D、E两元素形成的气态氢化物,稳定性强的是 (写化学式)。
(3)五种元素中的三种组成易溶于水的物质,其中能促进水电离的物质是 (写化学式,写一个即可,下同),能抑制水电离的物质是 。
(4)1g B2A2气体在E单质中完全燃烧,生成一种液体化合物和另一种对环境无害的气体,放出50.0kJ的热量,写出该反应的热化学方程式 。
21.(10分)如图所示装置:
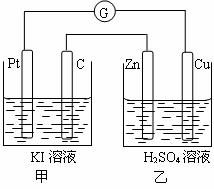
(1)若装置的外电路中,电子由铂电极流向铜电极,则铜电极为 极,甲池为 池,石墨电极上的反应现象为 ,铂电极上发生的电极反应式为 。
(2)若将检流计G换为直流电源,乙池中的电解液为500mL 2 mol·L-1的硫酸,通电一段时间后铂电极上在标准状况下收集到气体体积为11.2L,此时乙池为 池,乙池中的电池总反应式为 ,硫酸溶液的浓度为 。(不考虑溶液的体积变化)
20.(8分)汽车在给人们带来方便的同时,也带来了许多问题,如汽车排出的尾气污染。目前人们已经研制出汽车尾气处理装置,这种装置可以将汽车尾气中的有害气体转化为对环境无害的物质。某课外小组利用下图实验装置模拟汽车尾气的处理过程,试回答下列问题:
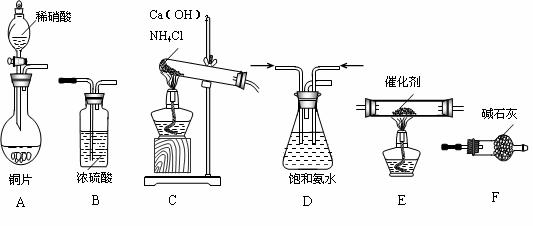
(1)汽车尾气中污染空气的主要物质有 。
(2)为探究使汽车中的部分有害气体转化为无害物质的方法,实验中需要的仪器及连接顺序为(填仪器代号):
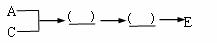
(3)另一同学设计如下连接顺序:
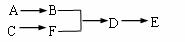
此时D中的液体需改成 。(填序号)A.水 B.汽油 C.四氯化碳
(4)E中的化学方程式为 。
(5)上述两种方案设计均存在明显缺陷,你认为它是 。
19.(9分)某校综合实践小组用废铁屑制备FeCl3,用作印刷电路铜板腐蚀剂,并回收铜。活动过程如下:
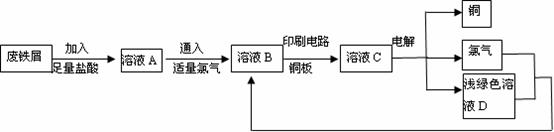
(1)该小组同学发现废铁屑中加入足量盐酸时,没有气泡产生,写出发生反应的离子方程式 、 。
(2)电解溶液C回收铜的过程中,阴极材料最好选用 ,电解过程中能量转化形式是 。
(3)已知溶液A中有Fe2+和Fe3+,请设计实验方案检验Fe2+的存在
(4)检验溶液C中含有Fe3+的试剂为 ,现象为 。
18.将4 mol A 气体和 2 mol B 气体在 2 L 的密闭容器中混合并在一定条件下发生如下反应 2A(g)+B(g) 2C(g) △H <0 ,4 s后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1 ,下列说法中正确的是
2C(g) △H <0 ,4 s后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1 ,下列说法中正确的是
A.反应过程中,当A 、B、C的物质的量浓度之比为 2:1:2时,反应达到平衡状态
B.4 s 内用物质B表示的反应速率为0.075 mol·L-1·s-1
C.达平衡后若增大压强,A的转化率降低
D.达平衡后若升高温度,C的反应速率减小
第Ⅱ卷 (非选择题 共56分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com