

1.投料:在圆底烧瓶中加入20mL水,再慢慢加入29mL浓硫酸,混合均匀并冷却至室温后,再依次加入0.20mol正丁醇(约18mL)和0.24mol溴化钠,充分振荡后加入几粒沸石。
(1)冷却至室温后再加正丁醇和溴化钠的目的是 。
A.减少HBr的挥发 B.防止正丁醇的挥发
C.防止溴化钠被氧化 D.防止温度过高导致炭化结焦
(2)本反应中硫酸与溴化作作用生成氢溴酸,氢溴酸与正丁醇作用发生取代反应生成正溴丁烷。硫酸的用量和浓度过大都对本制备不利的主要原因是 。
19.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,将按A题评分。
A.CrO3、NaBH4常用于醛、酮与醇的相互转化,由硼酸[H2BO3或B(OH)2]可以合成NaBH4。
(1)写出Cr元素原子在基态时的核外电子排布式: ;
(2)硼酸是一元弱酸,它的水溶液之所以呈弱酸性并非本身能电离出H+,而是它加合了一个OH-,这种电离方式可表示为:B(OH)3+H2O H++ (用结构式表示,如有配位键,请用“→”);在其电离产生的阴离子中B原子的杂化方式为
。
H++ (用结构式表示,如有配位键,请用“→”);在其电离产生的阴离子中B原子的杂化方式为
。
(3)与BH-4互为等电子体的一种阳离子是 ,BH-4离子的空间构型为 。
(4)硼酸是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是 。
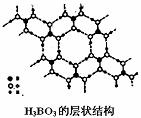
A.硼酸晶体属于原子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8e-稳定结构
D.含1mol H3BO3的晶体中有3mol氢键
B.由正丁醇(用n-C4H9OH表示)制备正溴丁烷(沸点:101.6℃)的反应如下:
n-C4H9OH+NaBr+H2SO4→n-C4H9Br+NaHSO4+H2O
副反应:n-C4H9OH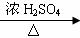 CH3CH2CH=CH2↑+H2O
CH3CH2CH=CH2↑+H2O
2n-C4H9OH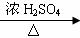 (n-C4H9)2O+H2O
(n-C4H9)2O+H2O
3H2SO4(浓)+2NaBr(固)===2NaHSO4+Br2↑+SO2↑+2H2O
已知反应物及其用量:固体NaBr0.24mol,n-C4H9OH0.20mol,浓H2SO429mL,H2O20mL。
制备过程经历如下五个步骤,试回答下列问题:
18.(10分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+Cl2(g) SO2Cl2(l)△H=-97.3kJ/mol
SO2Cl2(l)△H=-97.3kJ/mol
(1)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是 (用编号填空)。
A.缩小容器体积 B.使用催化剂
C.增加SO2浓度 D.升高温度
(2)已知20℃时,AgCl的溶解度为0.00015g,Ag2SO4的溶解度为0.796g。则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是 。
(3)300℃时,体积为1L的密闭容器中充入16.20gSO2Cl2,达到平衡时容器中含SO27.616g,则300℃的合成SO2Cl2反应的平衡常数为 。
(4)将(3)所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量(写出计算过程)。
17.(12分)磺胺(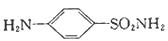 )是应用广泛的原料药及医药中间体,其合成路线如下:
)是应用广泛的原料药及医药中间体,其合成路线如下:
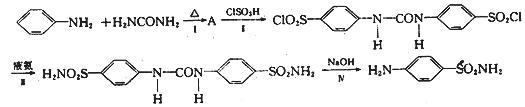
(1)在合成过程中,如果将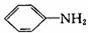 和H2NCONH2以2:1(物质的量之比,下同)反应则得到A,但如果以1:1反应则可以得到有机物B。
和H2NCONH2以2:1(物质的量之比,下同)反应则得到A,但如果以1:1反应则可以得到有机物B。
①写出A的结构简式 。
②B有多种同分异构体,符合下列要求的B的同分异构体有 种。
a.属于芳香族化合物;b.与银氨溶液反应有银镜生成;c.分子中苯环上有两种不同化学环境的氢原子。
(2)反应III的反应类型是 。
(3)写出反应IV的化学方程式 。
(4)以己二胺[H2N(CH2)6NH2]和CH2=CH2为原料,其它无机试剂自选,以流程图形式表示合成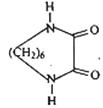 的过程。
的过程。
例:由乙醇合成聚乙烯的反应流程图可表示为:
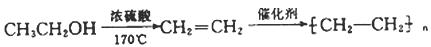
16.(12分)过氧化氢(H2O2)是一种绿色氧化剂。
(1)某文献报道了不同金属离子及其浓度对H2O2氧化降解海藻酸钠溶液反应速率的影响,实验结果如下图所示。
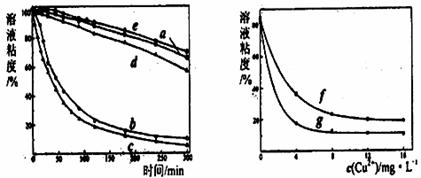
注:以上实验均在温度为20℃、ω(H2O2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg/L条件下进行。
图I中,a:H2O2 b:H2O2+Cu2+ c:H2O2+Fe2+ d:H2O2+Zn2+ e:H2O2+Mn2+
图II中,f:反应时间为1h, g:反应时间为2h
①由上述信息可知,下列叙述正确的是 (填字母)。
A.海藻酸钠溶液粘度的变化加慢可反映出其降解反应速率的快慢
B.Zn2+对该降解反应的催化效率比Cu2+和Fe2+高
C.相同条件下,Cu2+浓度越大,该降解反应速率越快
D.一定条件下,Cu2+浓度一定时,反应时间越长,溶液粘度越小
②由图I知Mn2+能使该降解反应的反应速率 (填“减慢”或“加快”),其原因可能是 。
(2)H2O2可用于制备过氧乙酸(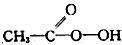 ,弱酸),所以在过氧乙酸中常残留H2O2。某研究性学习小组为测定某产品中过氧乙酸的浓度,进行如下操作:
,弱酸),所以在过氧乙酸中常残留H2O2。某研究性学习小组为测定某产品中过氧乙酸的浓度,进行如下操作:
步骤1:准确量取V mL待测溶液于锥形瓶中,滴加少量硫酸;
步骤2:用浓度为c1 mol/L的KMnO4标准溶液滴定至终点,消耗KMnO4溶液体积为V1mL(只发生反应:MnO-4+H2O2+H+→Mn2++O2↑+H2O,未配平);
步骤3:向步骤2所得溶液中加入足量的KI溶液,摇匀,暗处放置5~10min(此时过氧乙酸转化为乙酸);
步骤4:用浓度为c2mol/L的Na2S2O3标准溶液滴定步骤3所生成的I2,接近终点时加入指示剂,最终消耗Na2S2O3溶液体积为V2mL
(发生反应为I2+2S2O2-3=2I-+S4O2-6);
①写出步骤3中“过氧乙酸转化为乙酸”的离子方程式 。
②步骤4中加入的指示剂为 。
③上述实验测得过氧乙酸的浓度为 mol/L(用含字母的代数式表示)。
15.(10分)
二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
I.工业制备二甲醚的生产流程如下:
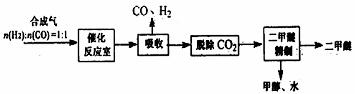
催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
CO(g)+2H2(g) CH3OH(g) △H=-90.7kJ/mol ①
CH3OH(g) △H=-90.7kJ/mol ①
2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol ②
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol ②
CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ/mol ③
CO2(g)+H2(g) △H=-41.2kJ/mol ③
(1)甲烷氧化可制合成气:CH4(g)+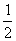 O2(g)
O2(g) CO(g)+2H2(g),
CO(g)+2H2(g),
△H=-35.6kJ/mol。该反应是 反应(填“自发”或“非自发”)。
(2)催化反应室中总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的
CH3OCH3(g)+CO2(g)的
△H= 。830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)
(3)上述流程中,可以循环使用的物质有 。
II.下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。
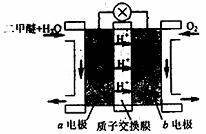
(1)b电极是 极。
(2)a电极的反应式为 。
14.(10分)
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程下如下:
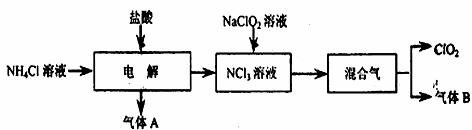
已知:①NCl3是黄色粘稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性臭味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。②气体B能使湿润的红色石蕊底纸变蓝。
回答下列问题:
(1)气体A的化学式为 。
(2)电解时,发生反应的化学方程式为 。为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;② 。
(3)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1:6混合在溶液中恰好反应生成ClO2,该反应的离子方程式为 。
(4)实验室制取气体B的化学方程式为 。
(5)在用二氧化氯进行水处理时,除了杀菌消毒外,还能除去水中Fe2+和Mn2+。写出用ClO2氧化除去Mn2+生成MnO2的离子方程式(ClO2反应后的产物为ClO-2) 。
13.(12分)
绿矾(FeSO4·7H2O)是治疗缺铁性贫血的特效药。下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法:
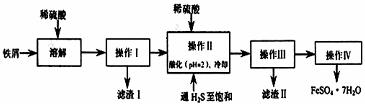
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0沉淀完全时的pH为5.5。
(1)检验得到的绿矾晶体中是否含有Fe3+的实验操作是 。
(2)操作II在溶液中用硫酸酸化至pH=2的目的是 ;通入硫化氢至饱和的目的是:
①除去操作I所得溶液中含有的Sn2+等杂质离子;
② 。
(3)操作IV的顺序依次为: 、结晶 。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;② 。
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL(滴定时发生反应的离子方程式为:5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O)。
①计算上述样品中FeSO4·7H2O的质量分数为 。
②若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有 ; 。
12.乙酸乙酯能在多种条件下发生水解反应:CH3COOC2H5+H2O CH3COOH+C2H5OH
CH3COOH+C2H5OH
已知该反应的速率随c(H+)的增大而加快。下图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是 ( )
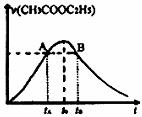
A.反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致
B.A、B两点表示的c(CH3COOC2H5)相等
C.图中t0时反应达到平衡状态
D.tB时CH3COOC2H5的转化率高于tA时CH3COOC2H5的转化率
非选择题,共78分
11.下表为短周期元素①~⑧的部分性质。
 元素编号 元素编号元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径/10-10m |
0.66 |
1.36 |
1.23 |
1.10 |
0.99 |
1.54 |
0.70 |
1.18 |
|
最高化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
最低化合价 |
-2 |
|
|
-3 |
-1 |
|
-3 |
|
下列说法正确的是 ( )
A.元素④⑤形成的化合物是离子化合物
B.元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性强
C.元素①⑧形成的化合物具有两性
D.上表8种元素中,元素③的最高价氧化物对应水化物的碱性最强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com