

16.有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体体积为(设反应中HNO3被还原成NO) ( )
A.0.448L B.0.672L C.0.896L D.0.224L
第Ⅱ卷 非选择题(共60分)
15.在0.1mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是 ( )
CH3COO-+H+,对于该平衡,下列叙述正确的是 ( )
A.加入水,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol/LHCl溶液,溶液中C(H+)减少
D.加入少量CH3COONa固体,平衡向正反应方向移动
14.下列各组离子一定能大量共存的是 ( )
A.含有大量CO32-的澄清透明溶液中:Na+、K+、Cl-、[Al(OH)4]-
B.能与金属铝反应放出氢气的溶液中:K+、NO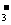 、Cl-、NH
、Cl-、NH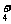
C.常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、ClO-、S2-、NH4+
D.pH=7溶液:Mg2+、Cl-、Fe3+、SO42-
13.下列溶液中微粒的物质的量浓度关系正确的是 ( )
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
B.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+2 c(H2CO3)
C.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+ c(H2CO3)
D.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
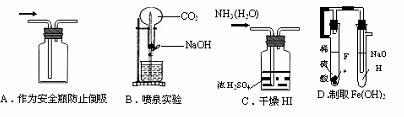
12.下列能达到实验目的的是 ( )
11.下图是198K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是 ( )
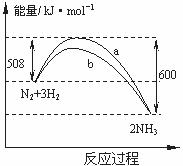
A.该反应的热化学方程式为:N2+3H2 2NH3
△H=-92kJ·mol-1
2NH3
△H=-92kJ·mol-1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入 2 mol N2和6mol H2反应后放出的热量为Q2kJ则184>Q2>2Q1
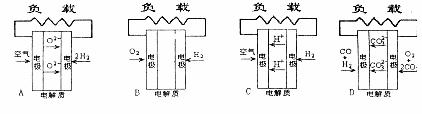
10.有四种燃料电池,A.固体氧化物燃料电池B.碱性氢氧化物燃料电池C.质子交换膜燃料电池D.熔融盐燃料电池,下面是工作原理示意图,其中正极反应生成水的是( )

9.下列离子方程式书写正确的是 ( )
A.H2SO4与Ba(OH)2溶液反应: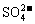 +Ba2++OH-+H+=H2O+BaSO4↓
+Ba2++OH-+H+=H2O+BaSO4↓
B.氯化铝溶液中加入过量氨水:Al3+ + 4NH3•H2O ===[Al(OH)4]- + 4NH4+ + 2H2O
C.ZnS与CuSO4溶液反应:ZnS+Cu2+= CuS+Zn2+
D.铜与AgNO3溶液反应:Cu+Ag+=Ag+ Cu2+
7.常温下,某溶液中由水电离出来的c(H+)=1.0×10-13mol·L-1,该溶液可能是( )
①二氧化硫 氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①② C.②③ D.③④
8.有一无色未知溶液中检验出有Ba2+、Ag+,同时又测得其酸性很强。某学生还要鉴定此溶液中是否大量存在①Cu2+ ②Fe3+ ③Cl- ④NO ⑤S2- ⑥CO 32-⑦NH4+ ⑧Mg2+ ⑨Al3+ ⑩[Al(OH)4]- 。其实这些离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是 ( )
A.③⑤⑥⑦⑩ B.①②⑤⑥⑧⑨
C.③④⑦⑧⑨ D.①②③⑤⑥⑩
6.如下图所示,两个甲分子反应生成三个乙分子和一个丙分子,则从图示获得的信息中,不正确的是 ( )
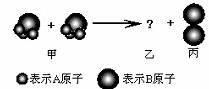
A.根据阿佛加德罗定律可推知,1个乙分子中含有2个A原子
B.该反应的反应类型为分解反应
C.反应生成的丙物质属于单质
D.反应中分子的种类、数目发生变化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com