
8.下列离子方程式中,错误的是 ( )
A.向AlCl3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH+4
B.碳酸钙溶于过量醋酸:CaCO3+2CH3COOH==Ca2++2CH3COO-+CO2↑+H2O
C.Fe2O3溶于过量的氢碘酸:Fe2O3+6H+=2Fe3++3H2O
D.向NaAlO2溶液中通入过量CO2制Al(OH)3:
AlO-3+CO2+2H2O=Al(OH)3↓+HCO-3
7.下列现象或事实可用同一原理解释的是 ( )
A.氯水和二氧化硫使品红溶液褪色
B.苯酚和二氧化硫均能使品红溶液褪色
C.亚硫酸钠和硅酸钠、漂白粉长期暴露在空气中变质
D.Al2(SO4)3溶液和NaHSO4溶液分别与NaHCO3溶液混合均放出CO2气体
6.下列物质熔化或气体时,所克服的粒子间的作用(力),属于同种类型的是 ( )
A.碘和氢氧化钠 B.二氧化硅和生石灰
B.二氧化硅和生石灰
C.苯和己烷 D.氯化钠和铁的熔化
22.[化学一有机化学基础]
(10分)已知一个碳原子上连有两个羟基时,易发生下列转化: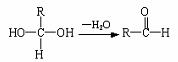 .已知:A、B存在如下图转化关系,请根据下图回答。
.已知:A、B存在如下图转化关系,请根据下图回答。
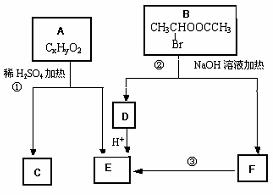
请根据下图回答。
(1)物质B能发生的反应类型是_____________________。(填序号)
A.取代反应 B.水解反应 C.消去反应
(2)已知在相同情况下,等质量氢气的体积是A蒸汽的81倍,16.2gA在氧气中完全燃烧,生成44gCO2和9gH2O,则A的化学式为______________________。
(3)C具有如下特点:能跟FeCl3溶液发生显色反应;能发生加聚反应;苯环上的一氯代物只有两种。写出反应①的化学方程式 。
(4)化合物G是C的同分异构体,它属于芳香族化合物,能发生银镜反应。G有多种结构,写出其中只有一个取代基的同分异构体的结构简式: ______________________。
22.(10分)[化学一物质结构与性质]
A、B、C、D四种元素处于同一周期,在同族元素中,A的气态氢化物的沸点最
高,B的最高价氧化物对应水化物的酸性在同周期中最强,C的电负性介于A、B之间,
D与B相邻。
(1)C原子的价电子排布式为________________________________________
(2)A、B、C三种元素原子的第一电离能由大到小的顺序是(写元素符号)_____。
(3)B的单质分子中存在 个π键;D的气态氢化物DH3。分子中的中心原子轨道采用______杂化。B和D形成一种超硬、耐磨、耐高温的新型化合物,该化合物属于______晶体,其硬度比金刚石________(填“大”或“小”)。
(4)A的气态氢化物的沸点在同族中最高的原因是_____________________________
21.(8分)有①-----⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下图:

已知②形成化合物种类最多,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:________________________(用化学式表示)。
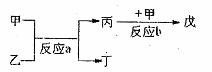
(2)若甲、乙、丙、丁、戊均为上述①---⑧八种短周期元素中的某些元素组成的单质或由其中两种元素组成的化合物,且甲、戊为无色气体,反应a为置换反应,反应b为化合反应。见下图示转化关系。推测:戊可能为:____________、___________(列举合适的两例)。
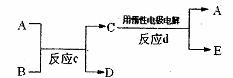
(3)若下图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物.已知:A是常见的金属单质,反应C为置换反应类型。若反应C是用A作电极,在B的水溶液中进行电解反应,它们有如下图示转化关系。则反应d中阴极的电极反应式为: ___________________
若反应C是在高温下进行的,且为工业上有重要应用价值的放热反应,当物质C是一种两性化合物,则反应C的化学方程式为: 。
20.(10分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜的反应情况,回答下列问题:
(1)在100mL18mol/L的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
A.40.32L B.30.24L
C.20.16L D.6.72L
有同学提出,若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,请判断该方案是否可行?若不可行,请说明原因。若可行,请写出反应的离子方程式 。
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是 。则反应中所消耗的硝酸的物质的量可能为
A.0.1mol B.0.15mol
C.0.2mol D.0.25mol
(3)①甲同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 .
19.(10分)铁单质及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为:
3FeS2+8O2 6SO2+Fe3O4,3 mol FeS2参加反应转移 mol电子。
6SO2+Fe3O4,3 mol FeS2参加反应转移 mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为_______________。从腐蚀废液回收得到金属铜还需要的试剂_____________。
(3)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
(4)钢铁的析氢腐蚀简单示意图如下。该图某处稍作修改即可成为钢铁电化学防护的简单示意图,请直接在图中作出修改并标出电子流动方向。
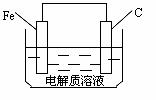
18.(8分)工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤。
(1)某温度下,SO2(g)+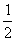 O2(g)
O2(g)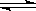 SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=
。
SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=
。
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)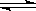 2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是
(填字母)。
2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是
(填字母)。
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 mol O2
D.保持温度和容器内压强不变,充入1 mol SO3
E.升高温度
F.移动活塞压缩气体
(3)某人设想以下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式: 。
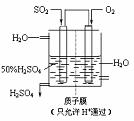
(4)若通入SO2的速率为2.24 L•min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为 mL•min-1。
17.(14分)下列几个实验可快速制取实验所需的少量气体,并进行相关性质实验。(实验装置如下图所示)
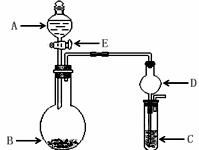
(1)若A中为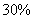 的H
的H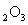 溶液,B中固体为
溶液,B中固体为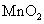 , C中盛有
, C中盛有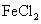 和KSCN的混合液,旋开E后,C中的现象是变红色,C中发生氧化还原反应的离子方程式是 _.
和KSCN的混合液,旋开E后,C中的现象是变红色,C中发生氧化还原反应的离子方程式是 _.
(2)若A中浓盐酸,B中装有固体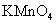 ,C中盛有KI淀粉溶液,旋开E后,B中出现哈绿色气体。已知1mol KM
,C中盛有KI淀粉溶液,旋开E后,B中出现哈绿色气体。已知1mol KM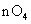 发生反应时转移5mol电子,且生成的气体为单质。B中发生反应的化学方程式是_________,C中的现象是____________;继续反应一段时间后,发现C中溶液的颜色褪去,这是因为在溶液中___________。
发生反应时转移5mol电子,且生成的气体为单质。B中发生反应的化学方程式是_________,C中的现象是____________;继续反应一段时间后,发现C中溶液的颜色褪去,这是因为在溶液中___________。
(3)若B中是生石灰,将A中液体逐滴加入B内,C中盛有铝盐溶液,试验中观察到C 出现沉淀,最后沉淀也不溶解,A中液体名称是__________C中发生反应的离子反应方程式___________。仪器D在此实验中的作用是___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com