
1.2009年12月7–18日在丹麦首都哥本哈根,召开了全球气候会议,商讨2012年至2020年的全减排协议。下列行为中不符合“促进低碳经济”宗旨的是 ( )
A.发展水电,开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖
B.限制化学发展,关停化工企业,消除污染源头
C.推广煤的气化、液化技术,提供清洁、高效燃料和基础化工原料,挖掘使用价值
D.推广利用微生物发酵技术,将植物桔杆、动物粪便等制成沼气以替代液化石油气
29.莽草酸是合成治疗H1N1的药物-达菲(Tamiflu)的原料之一。莽草酸是A的一种异构体。A的结构简式如下:
 (提示:环丁烷
(提示:环丁烷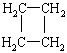 可简成写□)
可简成写□)
(1)A的分子式是 。
(2)A与溴的四氯化碳溶液反应的化学方程式(有机物用结构简式表示)
(3)A与氢氧化钠反应的化学方程式(有机物用结构简式表示)是
(4)17.4g A与足量碳酸氢钠溶液反应,计算生成二氧化碳的体积L(标准状况)。
(5)A在浓硫酸作用下加热可得到B(B的结构简式为HO- -COOH),其反应类型是
。
-COOH),其反应类型是
。
(6)B的同分异构体中既含有酚羟基又含有酯基的共有 种,写出其中一种同分异构体的结构简式 。
28.(15分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
I.测定过氧化的含量
请填写下列空白:
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
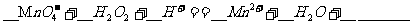
(3)滴定时,将高锰酸钾标准溶液注入______________________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是___________________________________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为_____________________________________
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
II.探究过氧化氢的氧化性
根据所提供的实验条件设计一个实验,证明过氧化氢的氧化性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选)。请将实验步骤和实验现象填入下表:
|
实验内容 |
实验步骤 |
实验现象 |
|
验证氧化性 |
|
|
27.(15分)中学化学中几种常见物质的转化关系如下:
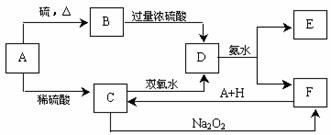
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。(各步转化中部分反应物或产物略去)请回答下列问题:
(1)A、B、H的化学式:A____________、B___________、H__________。
(2)红褐色胶体中F粒子直径大小的范围:____________________________。
(3)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:_______________________________________________________。
(4)①H2O2分子的电子式:__________________。
②写出C的酸性溶液与双氧水反应的离子方程式:__________________________。
(5)写出鉴定E中阳离子的实验方法和现象:____________________________。
26.(15分)
X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:已知一个B分子中含有的Z元素的原子个数比一个C分子中少1个。请回答下列问题:
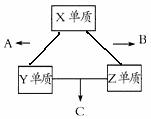
(1)X元素在周期表中的位置是 。
(2)X单质与Z单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入 (填物质名称)气体;负极电极反应式为 。
(3)X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W溶液吸收生成一种盐。该盐的水溶液pH 7(填“大于”、“小于”或“等于”)其原因是(用离子方程式表示): 。
(4)C在一定条件下反应生成A的化学方程式是 。
(5)已知Y单质与Z单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温条件下反应。下列说法中正确的是 (填写字母编号);
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中,气体平均相对分子质量逐渐增大
e.达到化学平衡后,再升高温度,C的体积分数增大
13.向体积为Va的0.02mol·L-1CH3COOH溶液中加入体积为Vb的0.02mol·L-1KOH溶液,下列关系错误的是 ( )
( )
 A.Va=Vb时:c(CH3COOH)=c(K+)>c(OH-)=c(H+)
A.Va=Vb时:c(CH3COOH)=c(K+)>c(OH-)=c(H+)
 B.Va=Vb时:c(CH3COO-)+ c (H+)= (OH-)
B.Va=Vb时:c(CH3COO-)+ c (H+)= (OH-)
 C.Va>Vb时:c(CH3COOH) +c(CH3COO-)>c (K+)
C.Va>Vb时:c(CH3COOH) +c(CH3COO-)>c (K+)
 D.Va与Vb任意比时:c(K+)+ c(H+) =c(OH-)+ c(CH3COO-)
D.Va与Vb任意比时:c(K+)+ c(H+) =c(OH-)+ c(CH3COO-)
第Ⅱ卷(非选择题)
12.由氢气和氧气反应生成1mol水蒸气放出241.8kJ的热量,1g水蒸气转化为液态水放出2.45kJ的热量,则下列热化学方程式书写正确的是 ( )
A.H2(g)+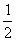 O2(g)=H2O(1) △H=-285.9kJ/mol
O2(g)=H2O(1) △H=-285.9kJ/mol
B.H2(g)+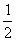 O2(g)=H2O(1) △H=-241.8kJ/mol
O2(g)=H2O(1) △H=-241.8kJ/mol
C.H2(g)+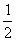 O2(g)=H2O(1) △H=+285.9kJ/mol
O2(g)=H2O(1) △H=+285.9kJ/mol
D.H2(g)+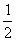 O2(g)=H2O(g) △H=+241.8kJ/mol
O2(g)=H2O(g) △H=+241.8kJ/mol
11.在下列给定条件的溶液中,不能大量共存的离子组是 ( )
A.含有大量Al3+的溶液:Na+、NH+4、SO2-4、Cl-
B.水电离c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、SO2-4、HCO-3
C.含有大量NO-3的溶液:H+、Fe3+、SO2-4、Cl-
D.常温下,pH=12的溶液:Na+、K+、AlO-2、NO-3
10.下图表示反应X(g) 4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化的曲线:下列有关该反应的描述正确的是 ( )
4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化的曲线:下列有关该反应的描述正确的是 ( )
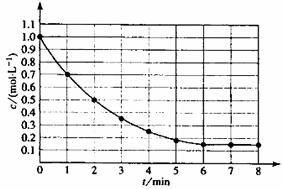
A.第6min后,反应就终止了
B.X的平衡转化率为85%
C.若升高温度,X的平衡转化率将大于85%
D.若降低温度,v正和v逆将以同样倍数减小
9.用NA表示阿伏加德罗常数的值,下列说法错误的是 ( )
A.在1L 0.1mol·L-1碳酸钠溶液中,阴离子总数大于0.1NA
B.标准状况下,11.2LCO2和O3混合气体中含有的原子数是1.5NA
C.由CO2和SO2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.标准状况下,5.6L一氧化氮和5.6L氧气混合后的分子总数为0.5NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com