
19.(10分)已知2X2(g)+Y2(g)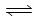 2Z(g)
ΔH=-aKJ·mol-1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2,在500℃时充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
2Z(g)
ΔH=-aKJ·mol-1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2,在500℃时充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
(1)此反应平衡常数表达式为 ;若将温度降低到300℃,则反应平衡常数将 (填增大、减少或不变)
(2)若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量C KJ,则Z浓度
Wmol·L-1(填“>”、“<”或“=”),a、b、c之间满足关系 (用代数式表示)
(3)能说明反应已达平衡状态的是
A.浓度c(Z)=2c(Y2) B.容器内压强保持不变
C.v逆(X2)=2v正(Y2) D.容器内的密度保持不变
(4)若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2mol X2和1mol Y2达到平衡后,Y2的转化率将 (填变大、变小或不变)
18.下列实验操作或原理不正确的是 ( )
A.进行焰色反应时,必须用稀硫酸洗涤并灼烧铂丝,然后再进行实验
B.分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
C.纸层析法中的展开剂之所以能够展开的主要原理是毛细现象
D.读取滴定管内液体体积时,俯视读数导致读数偏小
第Ⅱ卷(非选择题,共56分)
17.CO与H2在催化剂作用下合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温。实验测得相关数据如下图1和图2。
CH3OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温。实验测得相关数据如下图1和图2。
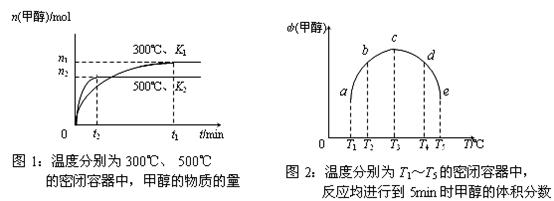
下列有关说法正确的是 ( )
A.该反应的正反应是气体体积减小的吸热反应
B.K1<K2 (K为该条件下反应的平衡常数)
C.反应进行到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动
D.将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或减压
16.已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H=74.9 kJ·mol-1,下列说法中正确的是
( )
A.该反应中熵变、焓变皆大于0
B.该反应是吸热反应,因此一定不能自发进行
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
15.镁铝合金5.1g 完全溶于过量的热浓硝酸中,反应中共产生11.2 L NO2(标准状况下测定),若在反应后溶液中加入足量的氢氧化钠溶液,则生成沉淀质量为 ( )
A.13.6 g B.7.8g C.5.8g D.4g
14.利用相关数据作出的推理或判断不正确的是 ( )
A.利用键能大小的数据,可以估算化学反应的焓变
B.利用原子半径的数据,可推断元素的主要化合价
C.利用沸点数据,可推测能否将一些液体混合物用分馏的方法分离
D.利用溶度积数据,可比较BaSO4和BaCO3在水中的溶解性大小
13.如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是 ( )

A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变 浑浊
C.若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中先产生白色沉淀后沉淀又溶解
D.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
12.下列离子方程式正确的是 ( )
A.锌和稀硝酸的反应:Zn+2H+=Zn2++H2↑
B.氯气和水的反应:Cl2+H2O=2H++Cl-+ClO-
C.向硫酸铝溶液中滴加过量的氢氧化钡溶液
2Al3++3SO42-+3Ba2++8OH-=2AlO2-+3BaSO4↓+4H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3-
11.下列物质性质中,可以证明某化合物内一定存在离子键的是 ( )
A.水溶液能导电 B.由金属和非金属元素的原子组成
C.熔融状态能导电 D.可以溶于水
10.下列实验装置图完全正确的是 ( )

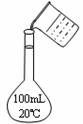
A.称量氢氧化钠固体 B.配制100 mL 0.10 mol·L-1盐酸
B.配制100 mL 0.10 mol·L-1盐酸

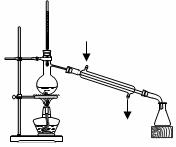
C.简易测定中和热 D.实验室制取蒸馏水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com