
5.对可逆反应:4NH3(g)+5O2(g)  4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成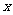 mol NO的同时,消耗
mol NO的同时,消耗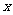 mol NH3,则反应达到平衡状态
mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是2v正(NH3)=3v正(H20)
4.工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g) Si(s)+4HCl(g) △H=+a
kJ·mol-1(a>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g) △H=+a
kJ·mol-1(a>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为a kJ
C.反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol·L-1·min-1
D.当反应吸收热量为0.025a kJ时,生成的HCl通入100 mL l mol·L-1的NaOH溶液恰好反应
3.25℃和1.01×105 Pa时,下列反应:2N2O5(g) 4NO2(g)+O2(g) △H=+56.76 kJ/mol,自发进行的原因是
4NO2(g)+O2(g) △H=+56.76 kJ/mol,自发进行的原因是
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.熵增大效应大于能量效应
2.将CoCl2溶解于盐酸中可以形成CoCl42-,在溶液中存在下面的化学平衡:
Co2+ +4C1- CoCl42- △H>0
CoCl42- △H>0
粉红色 蓝色
下列说法正确的是
A.升高温度,正反应速率增大,逆反应速率减小
B.该反应的平衡常数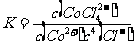
C.将盛有COCl2和盐酸混合液的试管置于热水中,试管内溶液为红色
D.增大Cl-的浓度,平衡向正反应方向移动,CO2+、Cl-的浓度都减小
1.下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2 (g)==2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热化学方程式为:
NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(1) △H=-56.4kJ/mol
C.已知C(石墨,s)==C(金刚石,s) △H>0,则金刚石比石墨稳定
D.已知2C(s)+2O2 (g)==2CO2 (g) △H1
2C(s)+O2 (s)==2CO(g) △H2 则△H1>△H2
24.(10分)
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:
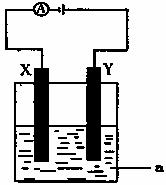
①若a为CuSO4溶液,则电解时的化学反应方程式为 。
通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的pH = (假设电解后溶液体积不变)。
23.(9分)氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等,为获得纯净的氧化铜并探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
(1)制备氧化铜:

①步骤Ⅰ的目的是除去不溶性杂质。操作是 。
②步骤Ⅱ的目的是除去硫酸亚铁。操作是:滴加H2O2溶液,稍加热;Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。滴加H2O2的目的是 ,加入Cu2(OH)2CO3粉末的目的是 。
③步骤Ⅲ的目的是得到CuSO4·5H2O晶体,操作是将CuSO4·5H2O溶液加热蒸发至有晶膜出现时,停止加热, ,水浴加热烘干。采用水浴加热的原因是 。
(2)探究氧化铜性质:
①取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡,结论是 。
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器除导管、橡皮塞、水槽外还必须有 。
22.(9分)物质A、E、F的焰色反应呈黄色,物质I的分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①-⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
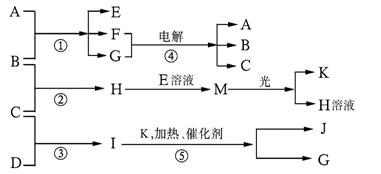
请填写下列空白:
(1)写出下列物质的化学式:B: ;J:_________。
(2)写出下列反应的方程式:
①反应①的离子方程式: 。
②反应⑤的化学方程式: 。
(3)在通常状况下,若1gC气体在B气体中燃烧生成H气体时放出92.3kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为:
。
21.(8分)常温下,将某一元酸HX和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HX物质的量 浓度(mol·L-1) |
NaOH物质的量 浓度(mol·L-1) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
C1 |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
C2 |
C2 |
pH=10 |
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,
若a 7(填>、<或=),则HX为强酸;
若a 7(填>、<或=),则HX为弱酸。
(2)在乙组混合溶液中离子浓度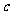 (X-)与
(X-)与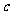 (Na+)的大小关系是
。
(Na+)的大小关系是
。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HX是 酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的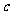
 =
mol·L-1。
=
mol·L-1。
20.(10分)如图是元素周期表的另一种画法--塔式周期表,在上面标有部分族序数及部分元素,请回答下列问题:
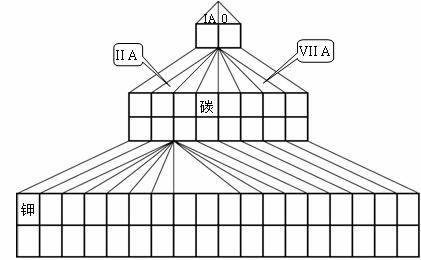
(1)请在图上把VA族涂黑。
(2)短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素最外层电子数是其内层电子总数3倍;C元素与B元素同族;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,试回答:
①写出B、C元素的名称__________、___________;在塔式周期表相应位置标出D元素的元素符号。
②写出一种由B、D元素组成的化合物的电子式: 。
③A的固态氧化物属于 晶体。(填“分子”、“原子”或“离子”)
④写出C的最高价氧化物的水化物与D的氧化物对应的水化物反应的离子方程式:
。
(3)在上述塔式周期表中列出了5行元素,每行所包含的元素种类分别为2、8、8、18、18,则未列出的第六行所包含的元素为________种。请根据行数与元素种数的关系,预言第八行最多可能含有__________种元素。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com