

15.某探究小组利用丙酮的溴代反应(CH3COCH3+Br2 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率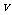 (Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
|
实验 |
初始浓度c/mol·L-1 |
溴颜色消失 所需时间t/s |
||
|
序号 |
CH3COCH3 |
HCl |
Br2 |
|
|
① |
0.80 |
0.20 |
0.001 0 |
290 |
|
② |
1.60 |
0.20 |
0.001 0 |
145 |
|
③ |
0.80 |
0.40 |
0.001 0 |
145 |
|
④ |
0.80 |
0.20 |
0.002 0 |
580 |
分析实验数据所得出的结论不正确的是
A.增大c(CH3COCH3),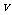 (Br2)增大 B.实验②和③的
(Br2)增大 B.实验②和③的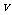 (Br2)相等
(Br2)相等
C.增大c(HCl),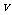 (Br2)增大 D.增大c(Br2),
(Br2)增大 D.增大c(Br2), (Br2)增大
(Br2)增大
第Ⅱ卷(非选择题,共55分)
14.在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH H3COO-+H+对于该平衡,下列叙述正确的是
H3COO-+H+对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
13.在室温下等体积的酸和碱的溶液,混合后pH值一定小于7的是
A.pH=3的硝酸跟pH=11的氢氧化钾溶液
B.pH=3的醋酸跟pH=11的氢氧化钡溶液
C.pH=3的硫酸跟pH=11的氢氧化钠溶液
D.pH=3的盐酸跟pH=11的氨水
12.在一定温度时,可逆反应:2NO2 2NO+O2在体积不变的密闭容器中充入一定量的二氧化氮进行反应,一段时间后达到平衡状态的标志是
2NO+O2在体积不变的密闭容器中充入一定量的二氧化氮进行反应,一段时间后达到平衡状态的标志是
①单位时间内生成n mol O2的同时也生成2n mol NO2
②单位时间内生成n mol O2的同时也生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体平均相对分子质量不再改变的状态
⑦混合气体的压强不再发生变化
A.①④⑥⑦ B.②③⑤⑦ C.①④⑦ D.①④⑤⑥
11.可逆反应aA(g)+bB(g)  cC(g)+dD(g),根据图象判断,下列叙述正确的是
cC(g)+dD(g),根据图象判断,下列叙述正确的是
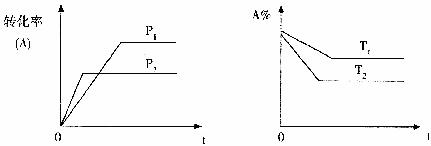
A.p1<p2,a+b<c+d,T1<T2,正向吸热
B.p1<p2,a+b>c+d,T1>T2,正向吸热
C.p1<p2,a+b<c+d,T1>T2,正向吸热
D.p1<p2,a+b<c+d,T1<T2,正向吸热
10.合成氨工业对国民经济和社会发展具有重要的意义。哈伯法合成氨需要在20-50MPa的高压和500%左右的高温下,并用铁触媒作为催化剂,氨在平衡混合物中的含量仍较少。最近英国俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)2的新催化剂,在常温下合成氨,反应方程式可表示为N2+3H2 2NH3。有关说法正确的是
2NH3。有关说法正确的是
A.哈伯法合成氨是吸热反应,新法合成氨是放热反应
B.新法合成氨不需要在高温条件下,可节约大量能源,具有发展前景
C.新法合成氨能在常温下进行是因为不需要断裂化学键
D.新催化剂降低了该反应的反应热,提高了活化分子百分数
9.在容积为1L的固定密闭容器中充入2 mol氨气,在一定条件下发生反应:
2NH3(g)  N2(g)+3H2(g),达到平衡时容器内c(N2)为0.5mol/L,若维持原温度和体积不变,按下列物质的量加入起始物质,达平衡时容器内c(N2)不能维持0.5mol/L的是
N2(g)+3H2(g),达到平衡时容器内c(N2)为0.5mol/L,若维持原温度和体积不变,按下列物质的量加入起始物质,达平衡时容器内c(N2)不能维持0.5mol/L的是
A.1mol N2和3mol H2 B.2mol NH3和lmol He
C.2mol NH3、1mol N2和3mol H2 D.0.1molNH3、0.95molN2和2.85molH2
8.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X(g)+3Y(g) 2Z(g),其平衡常数为1600(mol·L-1)-2
2Z(g),其平衡常数为1600(mol·L-1)-2
C.增大压强可使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
7.将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g) 2C(g)。若经2s后测得C的浓度为0.6
mol/L,现有下列几种说法。
2C(g)。若经2s后测得C的浓度为0.6
mol/L,现有下列几种说法。
①用物质A表示的反应的平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s)
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol/L
其中正确的是
A.①③ B.①④ C.②③ D.③④
6.100mL 2mol/L的盐酸跟过量的锌片反应,为加快反应速率,同时还不影响生成氢气的量,下列措施可行的是
A.加入适量的6mol/L的盐酸 B.加入数滴CuSO4溶液
C.加入适量的蒸馏水 D.加入适量氯化钠
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com