
5.厨房中的化学知识很多,下面是有关厨房中常见的操作或者常见现象,其中不属于氧化还原反应的是
A.炒菜用过的铁锅,放置常出现红棕色斑迹
B.用煤气灶燃烧沼气(主要成分为甲烷:CH4)为炒菜提供热量
C.牛奶久置变质腐败
D.用食醋除水垢[水垢主要成分是:CaCO3、Mg(OH)2]
4.有人分析一些小而可溶的有机分子的样品,发现它们含有碳、氢、氧、氮等元素,这些样品很可能是
A.脂肪酸 B.氨基酸 C.葡萄糖 D.淀粉
3.乙醇汽油的使用可以缓解石油危机,从甜菜或甘蔗中提取的蔗糖可以通过发酵产生乙醇。下列过程不涉及化学变化的是
A.甜菜的生长 B.蔗糖的发酵 C.乙醇的蒸馏 D.乙醇的燃烧
2.下列说法中不正确的是
A.符合通式Cm(H2O)n的物质一定是糖
B.葡萄糖所含的全部元素是C、H、O
C.糖类是人类维持生命的六大类营养物质之一
D.纤维素不能作为人类的营养食物
1.在日常生活中出现了“加碘食盐”、“增铁酱油”、“富硒茶叶”、“含氟牙膏”等名词,这里的碘、铁、硒、氟,应理解为
A.元素 B.单质 C.氧化物 D.分子
B.单质 C.氧化物 D.分子
20.(6分)在某温度下,重水(D2O)的离子积常数为1×10-12,若用pH一样的定义来规定pD=-lgc(D+),则该温度下:
(1)纯重水的pD=________;
(2)1L溶解0.01 mol的NaOD的D2O 溶液中,其pD=________;
(3)100mL 0.1mol·L-1的D2SO4的D2O溶液与100 mL 0.4 mol·L-1的KOD的D2O溶液混合后,pD=________。
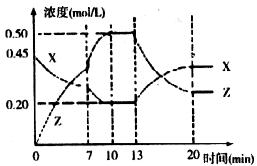
19.(16分)向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)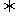 bZ(g)△H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g)△H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
(1)此反应的平衡常数表达式为K=________,随着温度的升高,上述平衡常数________ (填“增大”、“减小”或“不变”)。
(2)用X表示0~10min内该反应的平均速率为________,根据上图可求得方程式中a:b=________。
(3)0~10min容器内气体的压强逐渐________,气体的密度逐渐________ (填“变大”、“变小”或“无法确定”)。
(4)推测在第7min时曲线变化的原因可能是________ (填序号)。第13min时曲线变化的原因可能是________ (填序号)
①增加Z的量 ②增加X的量 ③升温 ④降温 ⑤使用催化剂
18.(15分)Ⅰ、用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
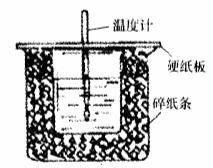
①从实验装置上看,图中尚缺少的一种玻璃用品是________。
②大烧杯上如不盖硬纸板,求得的中和热数值________ (填“偏大、偏小、无影响”)
③如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等、不相等”),所求中和热________(填“相等、不相等”)。
Ⅱ、如图所示在烧杯A、B中均盛有20℃、50mL水,试管C与D相通。其中充有红棕色气体,处于下列平衡2NO2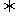 N2O4(△H<0)。当向A中加入10g NaOH固体使其溶解,向B中加入50g硝酸铵也使其溶解(20℃时,硝酸铵的溶解度为197g),则:
N2O4(△H<0)。当向A中加入10g NaOH固体使其溶解,向B中加入50g硝酸铵也使其溶解(20℃时,硝酸铵的溶解度为197g),则:

(1)A、B烧杯中,A杯溶液温度________,B杯溶液温度________(填“升高”、“降低”、“不变”)。
(2)试管C中气体颜色________ (填“变深”、“变浅”或“不变”),原因是________________。
(3)在测定NO2的相对分子质量时,较为适宜的条件是________、________。
17.(8分)一定温度下,有0.1mol/L的盐酸(a)、硫酸(b)、醋酸(c)各50mL,试比较:
(1)三种酸的pH由大到小的顺序是________ (填字母代号,下同)。
(2)三种酸跟足量的锌反应,开始时产生H2的速率由大到小的顺序是__________(不考虑锌的纯度及表面积等问题)
(3)三种酸跟足量的锌反应产生H2的体积由大到小的顺序是________。
(4)若三种酸溶液的pH相同,则相同体积的三种酸分别跟0.1mol/L的NaOH溶液中和,消耗NaOH溶液的体积由大到小的顺序是________。
16.(10分)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ·mol-1
。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ·mol-1
。请回答下列问题:
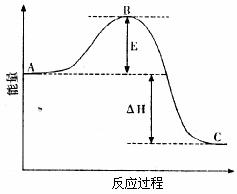
(1)图中A、C分别表示________、________,E的大小对该反应的反应热________(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点________ (填“升高”还是“降低”),△H________(填“变大”、“变小”或“不变”)。
(2)图中△H= ________KJ·mol-1;
(3)已知单质硫的燃烧热为296 KJ·mol-1,则由S(s)生成3 molSO3(g)的热化学方程式为________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com