
 |
 |
||
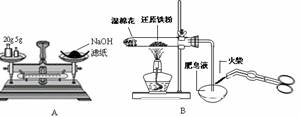
A.称量氢氧化钠固体 B.检验铁粉与水蒸气反应产生的氢气
2.下列有关实验操作正确的是
(A)(每个1分,共10分)(1) ;(2)N>P>S;(3)分子,直线,CO2 (N2O、CS2,写1个即可),
;(2)N>P>S;(3)分子,直线,CO2 (N2O、CS2,写1个即可), sp3;(4)配位键(写共价键也可) YBa2Cu3O7;(5)
sp3;(4)配位键(写共价键也可) YBa2Cu3O7;(5)
15. (2008年1月扬州二模)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2
(2008年1月扬州二模)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2
的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:
(1)基态氮原子核外电子排布的轨道表示式为______________________________。
(2)元素N、S、P的第一电离能(I1)由大到小的顺序为___________。
(3)HN3属于___________晶体,N3-的空间构型是_____,与N3-互为等电子体的分子的化学式为___________(写1种)。NH2-的电子式为___________,其中心原子的杂化类型是___________。
(4)CuCl2-中的键型为___________,超导氧化物A的化学式为___________。
(5)治癌药物B的结构简式为_________________。
 ① 写出A、B两种分子的立体结构及其中心原子的杂化方式________,________。
① 写出A、B两种分子的立体结构及其中心原子的杂化方式________,________。
② C、D与A具有相似的分子结构,且A、C、D三种分子的中心原子属于同族非金属,试推测由A、C、D构成的三种纯净物中沸点最高的是________(填A、C、D),原因是_______________________________________________。
(1)1s2;(2)73 kJ?mol-1;(3)①根据判断分子结构的理论可以判断出A为三角锥形,中以原子采用sp3杂化,B为平面三角形,中心原子采用sp2杂化。 ②A的沸点最高,A中存在氢键,C、D中不存在氢键。
(3)氢原子能与许多元素化合形成化合物。右图中“?”代表原子序数在1到10之间的原子实(原子实是原子除去价电子后剩余的部分),小黑点“?”代表未成键价电子,短线代表一个化学键。如H2O表示为:
14.请完成下列各题:
(1)氢负离子H-基态的电子排布式是_____。
(2)下列变化:H-(g)=H(g)+e-吸收的能量为73 kJ?mol-1,H(g)=H+(g)+e-吸收的能量为1311 kJ?mol-1l,则氢负电子H-的第一电离能为_____________________。
1.7
114
295
(3)晶格能的大小:MgO___________NaCl,键能的大小:HBr___________HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是___________
A.金刚石>晶体硅>二氧化硅>碳化硅 B.CI4>CBr4>CCl4>CH
(1)Na 1s22s22p63s1 HF 小 (各1分);(2)B 2分 ;(3)> > 各2分 ;(4)B (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com