
18. (10分)工业上制备BaCl2的工艺流程图如下:
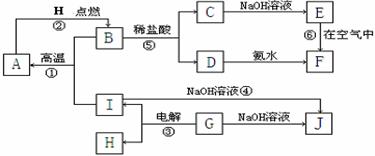
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素的原子结构示意图为_________;
(2)若C→D为化合反应,则此时的化学方程式________ ___;
(3)写出反应④的离子方程式_____________ _;
(4)写出反应③的电极方程式:阳极:______________ 阴极:____________
(5)从能量变化的角度看,①②③反应中属于△H>0的反应是_______。(填序号)
五、(本题包括1小题,共10分)
17.(10分)A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
(2)由1 mol气态DB2与B单质反应生成l mol气态DB3,放出98.3 kJ的热量,则由DB2 转化成DB3的热化学方程式是: ;
(3)写出C的阳离子和含C元素的阴离子在水溶液中反应的离子方程式: ;
(4)A2B和A2D比较,沸点高的是(写分子式) 。
16.(8分)A、B、C、D、E均为短周期元素且原子序数依次增大,B原子的最外层电子数是内层电子数的3倍,D元素的最高价氧化物的水化物呈酸性,D和B可形成DB2和DB3型化合物,A和E可形成18电子微粒,C元素是地壳中含量最多的金属元素。根据以上叙述回答下列问题:
(1)E元素在周期表中的位置是 ;
④加入5-10滴混合指示剂,用0.025mol/LHg(NO3)2标准溶液滴淀水样,滴定至蓝紫色。
试回答下列问题
(1)水样中加入氢氧化铝悬浊液的作用是: 。
(2)加入过氧化氢发生的离子反应为: 。
(3)加入对苯二酚的作用是: 。
(4)若滴定到终点时俯视滴定管读数,会导致水样中氯化物含量测定结果 (填“偏高”、“无影响”或“偏低”)。
(5)若用V1――水样消耗硝酸汞标准溶液的体积(mL),c――硝酸汞溶液浓度(mol/L),V――水样的体积(mL),则水样中氯离子的含量计算公式为:氯化物(Cl-,mg/L)= 用字母表示)。
15.(10分)国家环保总局于
一、滴定原理
①酸化的水样以硝酸汞[Hg(NO3)2]进行滴定时,生成难电离的氯化汞,滴定到终点时,过量的汞离子与指示剂二苯卡巴腙生成蓝紫色的二苯卡巴腙的汞络合物指示终点。
②饮用水中各种物质在通常的浓度下滴定时不发生干扰,但水的色质及高价铁、六价铬、硫化物对实验有干扰。
二、试剂
①配制氯化钠标准溶液和硝酸汞溶液,并用氯化钠标准溶液标定硝酸汞溶液
②配制氢氧化铝悬浊液、30%过氧化氢溶液及1%对苯二酚溶液等
三、 滴定
①水样加入氢氧化铝悬浊液振荡过滤
②若水样中有可溶性硫化物,需加氢氧化钠调至中性或弱碱性后,加入30%过氧化氢
③若水样含高铁离子或铬酸盐,可加2mL新配制的对苯二酚溶液
C、若金属全部溶解,且产生336 mL气体(标准状况),则b = 0.3
D、当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
第Ⅱ卷 (非选择题共72分)
14.某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL
b mol?L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
A、若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
B、若金属全部溶解,则溶液中一定含有Fe3+
反应过程中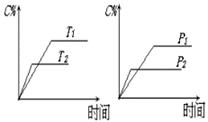 ,当其它条件不变时,C的百分含量(C%)与温
,当其它条件不变时,C的百分含量(C%)与温
度(T)和压强(P)的关系如右图,下列叙述正确的是
A、达到平衡后,加入催化剂则C%增大
B、达到平衡后,若升高温度,平衡向左移动
C、化学方程式中b >c +d
D、达平衡后,增加A的量,有利于平衡向右移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com