
21.(12分)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z?nH2O。工业上常用的一种制备流程为:
(1)将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
(A)升高温度 (B)降低温度 (C)增大压强
(D)减小压强 (E)加入催化剂 (G)移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到重要的化工原料,反应的化学方程式为________________________________________________________________________。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是__________________________________________________。
八、(本题包括1小题,共12分)
20.(10分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
19.(12分)某学校研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,产生的气体,具有可燃性,溶液温度迅速上升。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是___________。(填序号)
A.铝与Cl―反应,铝与SO42―不反应
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
E.生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)铝片表面出现的暗红色物质是 。
(3)放出的气体是________,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是 。
(4)某同学通过其它的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是_____________________。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片
(5)除去氧化铝的铝片与镁片为电极,在X电解质溶液中构成原电池,列表如下:
选项
铝电极
电解质
负极反应
正极反应
A
负极
NaOH
2Al―6e―+8OH―=2AlO2―+4H2O
6H2O+6e―=6OH―+3H2↑
B
负极
稀盐酸
2Al―6e―=2Al3+
6H++6e―=3H2↑
C
正极
浓硝酸
Mg+2e―=Mg2+
2NO3―+4H+―4e―=2NO2↑+2H2O
其中正确的是__ __(填序号),由此推知,金属作电极不仅与本身性质相关,而且与 __ 有关。
七、(本题包括1小题,共10分)
⑶反应C(s)
+ CO2(g)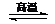 2CO(g)的△H2= kJ?mol-1。
2CO(g)的△H2= kJ?mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是 ,
。
六、(本题包括1小题,共12分)
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =
。
=
。
BaSO4(s) + 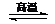 2CO2(g) + BaS(s) △H2=
226.2 kJ?mol-1 ②
2CO2(g) + BaS(s) △H2=
226.2 kJ?mol-1 ②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
BaSO4(s) + 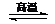 4CO(g) + BaS(s)
△H1 =
571.2 kJ?mol-1 ①
4CO(g) + BaS(s)
△H1 =
571.2 kJ?mol-1 ①

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com