
12.已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排列正确的是
A.c(OH―)>c(HA)>c(HB) >c(H+) B. c(OH―)>c(A―)>c(B―) >c(H+)
C. c(OH―)>c(B―)>c(A―) >c(H+) D. c(OH―)>c(HB)>c(HA) >c(H+)
[答案]A。
[解析]考查:电解质溶液中酸的电离、盐类的水解等知识。
酸越弱,对应的盐的水解程度越大,故同浓度的NaA和NaB,前者水解程度更大,因此其溶液中HA的浓度更大一些。盐类的水解一般来说是一些比较弱的反应,盐溶液中水解生成的分子的浓度要远小于原来的盐电离出的离子的浓度。又因为盐类水解的实质是阴离子或阳离子结合了水电离出的氢离子或氢氧根离子,使得其相应浓度剧烈减小,一般的,要小于生成的弱电解质分子的浓度。
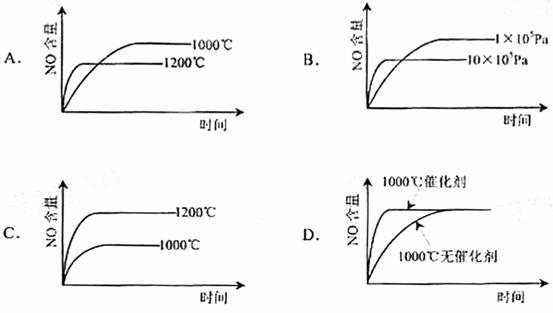
[答案]C。
[解析]考查:影响化学反应的速率的因素、化学平衡移动原理的应用等有关图像问题。4NH3(g)+5O2(g)=4NO(g)+6H2(g). △H=-1025KJ/mol。该反应是一个可逆反应。正反应是一个气体体积缩小的反应,也是一个放热反应。因此,温度越高,反应速率越快,达到平衡的时间越短;升高温度时,平衡向逆反应方向移动,NO的含量降低,故A是正确的,C是错误的。增大压强,反应速率加快,达到平衡的时间缩短,平衡向逆反应方向移动,NO的含量降低,故B是正确的。加入催化剂,反应速率加快,达到平衡式的时间缩短,但NO的含量不变,故D是正确的。
11.已知:4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g),△H = ―1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
10.下列叙述中正确的是
A.NH3、CO、CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.HF、HCl、HBr、HI的稳定性一次增强
D.CS2、H2O、C2H2都是直线型分子
[答案]B。
[解析] 考查:化学键的极性与分子极性的关系、分子的空间构型、分子的稳定性等判断。
A中CO2的是非极性分子;B是正确的;C按照此顺序,各物质的稳定性依次减小,因为分子内的共价键依次减弱;D水分子不是直线型的,是V形结构。
9.下列各组给定原子序数的元素,不能形成原子数之比为1:1稳定化合物的是
A.3和17
B.1和
[答案]D。
[解析]考查:原子序数、原子结构与物质构成的关系。
可将具体元素代入后再判断。各选项对应的元素和构成符合要求的化合物依次是:A.锂和氯,LiCl;B项中,H和O,H2O2;C项中,H和C,C6H6、C2H2等;D项中,N和Mg,Mg3N2。
8.下列各组物质不属于同分异构体的是
A.2,2-二甲基丙醇和2-甲基丁醇 B.邻氯甲苯和对氯甲苯
C.2-甲基丁烷和戊烷 D.甲基丙烯酸和甲酸丙酯
[答案]D。
[解析]考查:判断同分异构体、根据有机物名称写出其结构简式的能力。
[解析]根据有机物的名称,知道各选项中有机物的碳原子数是一样多的。D选项中的甲基丙烯酸中有两个双键(碳碳双键和碳氧双键),而甲酸丙酯中只有一个碳氧双键,故这两种物质不是同分异构体。
7.下列化合物,按其晶体的熔点由高到低排列正确的是
A.SiO2 CsCl CBr4 CF4
B. SiO2 CsCl CF4 CBr4
C. CsCl SiO2 CBr4 CF4
D. CF4 CBr4 CsCl SiO2
[答案]A。
[解析]考查:比较各种不同类型的晶体熔点高低。
比较固体物质的熔点时,首先是区分各晶体的类型:SiO2为原子晶体,CsCl为离子晶体,CBr4 、CF4分别为分子晶体。这几类晶体的熔点高低一般为:原子晶体>离子晶体>分子晶体。在结构相似的分子晶体中,分子的相对分子质量越大,熔点越高:CBr4 > CF4
6.在溶液中加入足量的Na2O2后仍能大量共存的离子组是
A.NH4+、Ba2+、Cl―、NO3― B.K+、AlO2―、Cl―、SO42―
C.Ca2+、Mg2+、NO3―、HCO3― D.Na+、Cl―、CO32―、SO32―
[答案] B。
[解析]考查:给定条件下的离子共存问题,过氧化钠的性质、。
过氧化钠有强氧化性,溶于水生成氢氧化钠和氧气。A中,NH4++OH-=NH3?H2O;
B中的离子之间不发生反应,与过氧化钠也不反应,故可以大量共存。
C中,HCO3―+OH―=CO32―+H2O,Ca2++ CO3― =CaCO3↓,Mg2++CO32―=MgCO3↓;D中的SO32―具有较强的还原性,过氧化钠会将其氧化成SO42-。
(Ⅱ)求数列.files/image334.gif) 的前
的前.files/image020.gif) 项和
项和.files/image337.gif) .
.
唐山市2008~2009学年度高三年级第一次模拟考试
(Ⅰ)求.files/image329.gif) 、
、.files/image331.gif) 的值及
的值及.files/image323.gif) 的表达式;
的表达式;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com