
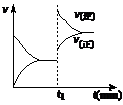 A.2SO2(g)+O2(g)
⇌ 2SO3(g);ΔH<0
A.2SO2(g)+O2(g)
⇌ 2SO3(g);ΔH<0
B.4NH3(g)+5O2(g) ⇌ 4NO(g)+6H2O(g);ΔH<0
C.H2(g)+I2(g) ⇌ 2HI(g); ΔH>0
D.C(s)+H2O(g) ⇌ CO(g)+H2(g);ΔH>0
20.下图为某化学反应的速率与时间的关系示意图。在t1 时刻升高温度或增大压强,速率的变化都符合示意图的反应是( )
19.在温度压强不变时,1mol NO2高温分解,生成NO和O2,达到平衡时容器内气体的物质的量变为1.2mol,这时NO2的转化率为 ( )
A.10% B.20% C.40% D.50%
18.对于任何一个化学平衡体系,采取以下措施,一定会使平衡发生移动的是( )
A.使用催化剂 B.升高温度 C.增大体系压强 D.加入一种反应物
17.反应C(s) + H2O(g) 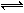 CO(g) + H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是:①增加碳的量②将容器的体积缩小一半③保持体积不变,充入N2使体系压强增大④保持压强不变,充入N2使容器体积增大( )
CO(g) + H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是:①增加碳的量②将容器的体积缩小一半③保持体积不变,充入N2使体系压强增大④保持压强不变,充入N2使容器体积增大( )
A.①② B.②③ C.①③ D.①④
16. 在密闭容器中,将2.0molCO与10molH2O混合加热到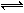 CO2(g)+H2(g) K=1.0 则CO转化为CO2的转化率A.83% B.17% C.50% D.60%
CO2(g)+H2(g) K=1.0 则CO转化为CO2的转化率A.83% B.17% C.50% D.60%
15.已知4NH3+5O2=4NO+6H2O,若反应速率分别用ν(NH3)、ν(O2)、ν(NO)、ν(H2O)表示,则正确的关系是( )
A.4ν(NH3)=5ν(O2) B.5ν(O2)=6ν(H2O)
C.2ν(NH3)=ν(H2O) D.4ν(O2)=5ν(NO)
14.下列说法正确的是
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
13.同温同压下,下列热化学方程式中Q值最大的是(均为放热反应)
A.
B.
C.
D.
C.一定小于92.0 kJ D.不能确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com