
⑴写出邻苯二甲酸氢钾(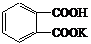 )与NaOH反应的化学方程式:
)与NaOH反应的化学方程式:
。
⑵将用分析天平精确称量的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液无色,再加入指示剂 (从甲基橙、酚酞、石蕊中选择),用NaOH溶液滴定到终点时,现象是 。
⑶该实验要用到的主要玻璃仪器 (写二种)
⑷该学生进行三次实验,所取固体的质量均相同,填写下表:
实验编号
邻苯二甲酸氢钾的质量(g)
待测NaOH溶液的体积(mL)
1
16.某学生用邻苯二甲酸氢钾(相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1。
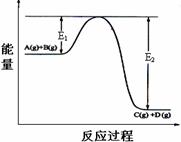 15.反应A(g)+B(g)
15.反应A(g)+B(g)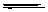
⑴Q 0(填“>”、“<”或“=”)
⑵该反应平衡常数K的表达式为: ,其他条件不变升高温度K__________(填“增大”“减小”“不变”),原因是_________________________
_____________________________________________
⑶反应体系中加入催化剂,反应速率增大,则E1的变化是:E1_______,ΔH的变化是:ΔH________(填“增大”“减小”“不变”)。
⑷反应在容积可变的密闭容器中进行,将容积缩小到原来一半,c(A)后
3Zn
+ 2K2FeO4 + 8H2O 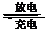 3Zn(OH)2 + 2Fe(OH)3
+ 4KOH,下列叙述不正确的是
3Zn(OH)2 + 2Fe(OH)3
+ 4KOH,下列叙述不正确的是
A.放电时负极反应为:Zn - 2e- + 2OH―= Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 -3e- + 5OH― = FeO42―+ 4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的pH下降
第Ⅱ卷(非选择题 共72分)
14.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:
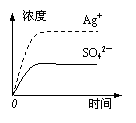 13.已知Ag2SO4的Ksp=2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42―浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034
mol/L)。若t1时刻在上述体系中加入100 mL 0.020 mol/L Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42―浓度随时间变化关系的是
13.已知Ag2SO4的Ksp=2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42―浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034
mol/L)。若t1时刻在上述体系中加入100 mL 0.020 mol/L Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42―浓度随时间变化关系的是
12.通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)∶n(硝酸亚汞) = 2∶1,则下列表述正确的是
A.在两个阴极上得到的银和汞的物质的量之比为1∶1
B.在两个阳极上得到的产物的物质的量不相等
C.硝酸亚汞的化学式为HgNO3
D.硝酸亚汞的化学式为Hg2(NO3)2
11.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中一定正确的是
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+) + c(H+) = c(HRO3-) + c(RO32-) + c(OH-)
C.c(H+) + c(H2RO3) = c(RO32-) + c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
10.某新型燃料电池,一极通入空气,另一极通丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该电池说法正确的是
A.在熔融电解质中,O2-由负极移向正极
B.电池总反应是:
C.通入空气的一极是正极,电极反应为:O2+4e- = 2O2-
D.通入丁烷的一极是正极,电极反应为:C4H10+26e-+13O2- = 4CO2+5H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com