
20.某二元酸(化学式用H
 ⑵铝与氢氧化钾溶液反应的离子方程式是:
⑵铝与氢氧化钾溶液反应的离子方程式是:
。
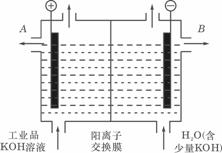
⑶工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阳极反应式是:
。
②通电开始后,阴极附近溶液pH会增大,请简述原因:
③除去杂质后的氢氧化钾溶液从液体出口_______(填写“A”或“B”)导出。
19.铝和氢氧化钾都是重要的工业产品。请回答:
⑴工业冶炼铝的化学方程式是 。
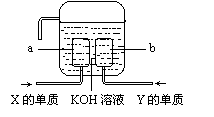 ⑷X、Y两种元素的单质已经被应用于飞船的燃料电池中,如右图所示,两个电极都由多孔性碳构成,通入的两种单质由空隙逸出并在电极表面放电。
⑷X、Y两种元素的单质已经被应用于飞船的燃料电池中,如右图所示,两个电极都由多孔性碳构成,通入的两种单质由空隙逸出并在电极表面放电。
①a是装置的 极。
②b极上的电极反应式是 。
18.有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:①X与Z、Y与W分别同主族;②X、Z、W分别与Y都能形成两种常见的化合物;③Y的阴离子与Z的阳离子核外电子排布相同,试根据以上叙述填空:
⑴写出由Y与Z形成的化合物Z2Y2的电子式: ,WY2与X2Y2反应生成粘稠油状液体的化学方程式: 。
⑵用离子方程式表示只含X、Z、W三种元素的化合物的水溶液呈碱性的原因:
。
⑶有两种化合物都只含上述四种元素,它们在水溶液中发生反应生成气体的离子方程式为: 。
17.工业上用MnO2和KOH为原料制取高锰酸钾,主要生产过程分两步进行。第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4的浓溶液进行电解,制取KMnO4。试回答以下问题:
⑴制取K2MnO4的MnO2是这一氧化还原反应的_____________剂(填“氧化”或“还原”),连续搅拌的目的是________________________________。
⑵电解K2MnO4的浓溶液时,两极发生的电极反应式为:
阴极是 ,
阳极是 ,
电解总的反应方程式是 。
16.96
⑸滴定中误差较大的是第 次实验,造成这种误差的可能原因是(只要写两种):
A.
B.
⑹NaOH溶液的物质的量浓度为 。
17.04
3
18.25
2
0.4162
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com