
⑵ 若正整数n, m, k成等差数列,比较109页.files/image018.gif) 与
与109页.files/image020.gif) 的大小,并说明理由!
的大小,并说明理由!
⑴ 求证:数列{109页.files/image016.gif) }是等差数列;
}是等差数列;
1、(江苏运河中学2009年高三第一次质量检测)设数列109页.files/image002.gif) 的前
的前109页.files/image004.gif) 项和为
项和为109页.files/image006.gif) ,
,109页.files/image008.gif) 为常数,已知对
为常数,已知对109页.files/image010.gif) ,当
,当109页.files/image012.gif) 时,总有
时,总有109页.files/image014.gif)
22.(6分)已知: H2的键能:D(H-H)=436kJ?mol-1,Cl2的键能:D(Cl-Cl)=247kJ?mol-1,以及以下热化学反应方程式H2(g)+Cl2(g)=2HCl(g),△H=-185kJ?mol-1。求HCl的键能D(H-Cl)。
潍坊四中2008―2009学年度上学期第一次诊断性测试
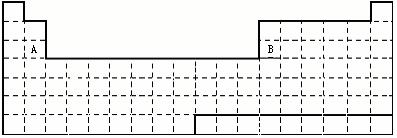
⑴请在上面元素周期表中画出金属元素与非金属元素的分界线。
⑵根据氢元素最高正价与最低负价的绝对值相等,你认为可把氢元素放在周期表中的___________族;有人建议将氢元素排在元素周期表的ⅦA族,请你写出支持这一观点的1个化学事实 。
⑶上表中元素A、B原子的最外层电子的电子排布式分别为 、 ;比较元素A与元素B的下列性质(填写“>”或“<”)。
原子半径:A_______B、电负性:A_______B、金属性:A_______B。
⑷某短周期元素最高正价为+7,其原子结构示意图为 。
21.(12分)
20.(10分) 下图中A、B、C、D四条曲线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素的气态氢化物的沸点,其中表示ⅥA族元素气态氢化物沸点的是曲线 ;表示ⅣA族元素气态氢化物沸点的是曲线 ;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是
;A、B、C曲线中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因是
。
19.(14分)A、B、C、D、E为5种由短周期元素构成的微粒,它们都有10个电子,其结构 特点如下:
微粒代码
A
B
C
D
E
原子核数
双核
多核
单核
多核
多核
电荷数
1-
0
2+
1+
0
其中:B是由极性键构成的4原子分子,A和D可以形成B和E。
(1)A、C、E的化学式是:A C E 。
(2)B分子是 分子(填“极性”或“非极性”),室温下,等物质的量的B与盐酸 反应后,溶液pH 7(填“<”、“>”或“=”),反应后溶液中溶质中存在 。
A.离子键B.极性键C.非极性键D.配位键
(3)B、E两种分子的空间构型分别为:B E 。
(4)已知B和E分子中存在着氢键,请写出另一种同样含有氢键的微粒,而且要求该微粒是分子且核外共含有10个电子: 。
18.(12分)原子结构与元素周期表存在着内在联系。根据已学知识,请你回答下列问题:
(1)指出31号元素镓(Ga)在元素周期表中的位置: 周期 族。
(2)被誉为“21世纪的金属”的钛(Ti)元素原子的价电子排布式为: 。
(3)写出原子序数最小的第Ⅷ族元素原子的核外电子排布式: 。
(4)写出3p轨道上有2个未成对电子的元素的符号: 。
(5)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素的价电子排布式为3d54s1,该元素的名称为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com