|
(1)在上面元素周期表中全部是金属元素的区域为 。 (2)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是 (填元素符号)。 (3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。 ①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。 ②甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是
。 a.将在空气中放置已久的这两种元素的块状单质分别放入热水中 b.将这两种元素的单质粉末分别和同浓度的盐酸反应 c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液 d.比较这两种元素的气态氢化物的稳定性
试题详情
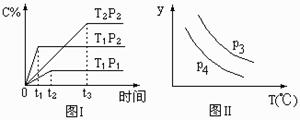
A.P3>P4,y轴表示B的百分含量 B.P3<P4,y轴表示B的体积分数 C.P3<P4,y轴表示混合气体的密度 D.P3>P4,y轴表示混合气体的平均摩尔质量 第II卷(共52分) 【考生注意】第25题分A、B两题,考生可任选一题。若两题均做,一律按A题计分。
试题详情
24.在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g) xC(g) 有图I所示的反应曲线(T表示温度,P表示压强,C%表示C的体积分数)。试判断对图II的说法中正确的是 xC(g) 有图I所示的反应曲线(T表示温度,P表示压强,C%表示C的体积分数)。试判断对图II的说法中正确的是
试题详情
23.c1、c 2、α 1、α 2、pH1、pH2分别表示两种一元弱酸的物质的量浓度、电离度和溶液的pH。如果已知pH1>pH2,α l>α 2,则c1和c 2的关系 A.c1>c2 B.c1=c 2 C.c1<c 2
D.无法确定
试题详情
22. 下列离子方程式书写正确的是 A.碳酸氢镁溶液中加入足量的石灰水 Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O B.在碳酸氢钙溶液中加入少量苛性钾溶液: Ca2++HCO3-+OH-=CaCO3↓+H2O C.K2S溶液显碱性的原因:S2-+H2O=HS-+OH-,HS-+H2O=H2S+OH- D.醋酸跟氢氧化钾溶液反应:H++OH―=H2O
试题详情
21.常温下,纯水中存在电离平衡:H2O H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是 H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是 A.H2SO4
B.AlCl3 C.NaHCO3
D.NaOH
试题详情
20.设某盐酸的pH=x,氨水的pH=y,已知x+y=14,且y>11。将上述两溶液分别取等体积充分混合后,所得溶液中各离子浓度由大到小的顺序是 A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) B.c(NH4+)>c (Cl-)>c(H+)>c(OH-) C.c(Cl-)>c(NH4+)>c(OH-)>c(H+) D.c(Cl-)>c (NH4+)>c(H+)>c(OH-)
试题详情
19.下列各组离子在溶液中能大量共存的是 A.Na+、S2-、OH-、AlO2-
B.SO32-、NO3-、H+、K+ C.Fe2+、Cu2+、ClO-、S2- D.H+、Na+、SO42-、S2O32-
试题详情
18.下列事实不能用勒沙特列原理解释的是 A.氨水应密封保存
B.浓硫酸在加热条件下能与铜反应,而稀硫酸不能 C.合成氨生产过程中使用过量氮气以提高氢气的转化率 D.实验室常用排饱和食盐水的方法收集氯气
试题详情
17.已知:①1g氢气完全燃烧生成水蒸气时放出热量121 kJ;②1molO2中的共价键完全断裂时吸收热量496 kJ;③H-O键的键能463kJ。则氢气中1molH-H键断裂时吸收热量为 A.920 kJ B.557 kJ C.436 kJ D.188 kJ
试题详情
| 