
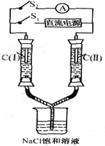
 15.如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液, C(Ⅰ)、c(Ⅱ)为多孔石墨电极。断开S2接通S1后,c(I)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.说明此时该装置形成了原电池。关于该原电池的叙述正确的是
15.如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液, C(Ⅰ)、c(Ⅱ)为多孔石墨电极。断开S2接通S1后,c(I)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.说明此时该装置形成了原电池。关于该原电池的叙述正确的是
A.C(I)的电极名称是负极
B.C(Ⅱ)的电极名称是阳极
C.C(I)的电极反应式是2H++2e一=H2↑
D.C(Ⅱ)的电极反应式是Cl2 +2e一=2Cl一
D.常温下与足量2mol/LNaOH溶液反应,放出H2的物质的量在0.45 ~0.6 mol之间
C.常温下与足量2 mol/L H2SO4溶液反应,放出H2的物质的量在0.45 ~0.6 mol之间
B.常温下与足量2mol/LHNO3溶液反应,最少可放出0.45 mol H2
A.常温下与足量18mol/LH2SO4溶液反应,最多可放出0.6 mol H2
14.某化学兴趣小组用回收的镁铝合金制取氢气。现有l0.8 g镁铝合金,下列说法正确的是
13.已知:SO32一+I2+H2O=SO42一+2H++2I一,某溶液中可能含有I一、 NH4+、Cu2+、SO32一,向该无色溶液中加人少量溴水,溶液仍呈无色,则下列关于泼溶液组成的判断正确的是
A.肯定不含I一 B.肯定不含Cu2+
C.可能含有SO32一 D.可能含有I一
12.某无色溶液,由Na+、Ba2+、Al3+、AlO2-、Fe3+、CO32-、SO42-中的若干种组成。取适量该溶液进行如下实验:① 加入过量盐酸,有气体生成;② 在①所得的溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;③ 在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。原溶液中一定存在的离子是
A.Al3+、Fe3+、SO42- B.Na+、AlO2-、CO32-
C.Na+、AlO2-、SO42-、CO32- D.Na+、Ba2+、AlO2-
11.下列反应的离子方程式错误的是
A.等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:
Ba2++2OH―+2H++SO42―=BaSO4↓+2H2O
B.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O
C.足量的CO2通入饱和碳酸钠溶液中:CO2+2Na++CO32―+H2O=2NaHCO3↓
D.向碳酸氢钠溶液中滴入过量澄清石灰水:Ca2++2OH―+2HCO3―=CaCO3↓+CO32―+2H2O
10.接触法制硫酸通常在400~500℃、常压和催化剂的作用下,用SO2与过量的O2反应生成SO3。 2SO2(g)+O2(g) 2SO3(g)
;△H < O 在上述条件下,SO2的转化率约为90%。但是部分发达国家采用高压条件制取SO3,采取加压措施的目的是
2SO3(g)
;△H < O 在上述条件下,SO2的转化率约为90%。但是部分发达国家采用高压条件制取SO3,采取加压措施的目的是
A.发达国家电能过量,以此消耗大量能源
B.高压将使平衡向正反应方向移动,有利于进一步提高SO2的转化率
C.加压可使SO2全部转化为SO3,消除SO2对空气的污染
D.高压有利于加快反应速率,可以提高生产效率
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com