

碱性,由于H++OH-=H2O使两水解平衡均正向移动,因此产生的气体为CO2,溶液浅棕红色为Fe(OH)3胶体的颜色。
【投影】例3
为了同时对农作物施用分别含有N、P、K三种元素的化肥,对于下列几种化肥①K2CO3,②KCl, ③Ca(H2PO4)2 ,④(NH4)2SO4,⑤氨水,你认为怎样搭配是最合理的?分析解释其理由。
讨论分析并回答:
N、P、K三种元素均为最佳组合,因此肯定有Ca(H2PO4)2,
同学甲:实验(1)中存在Mg(OH)2的溶解、结晶平衡: Mg(OH)2(固) 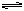 Mg2++2OH-。
Mg2++2OH-。
当加入NH4Cl时,由于NH4+水解
NH4++H2ONH3?H2O+H+,使溶液呈酸性。
H++OH-=H2O,从而使溶液中[OH-]减小,促进Mg(OH)2溶解,使溶液澄清。
同学乙:实验(1)中加入NH4Cl后,溶液中NH4+可与OH-结合从而使Mg(OH)2的溶解平衡右移使溶液澄清。
【追问】
甲、乙同学的两种解释谁的更有道理?启发引导分析实验(1)Mg(OH)2和 NH3? H2O哪个碱性更弱?
思考、讨论。
讨论回答:
实验方案:向盛有少量Mg(OH)2悬浊液的培养皿中加入CH3COONH4 固体,观察悬浊液是否变澄清。
【追问】
能否通过实验来进一步验证甲、乙同学的解释哪个合理?请同学设计实验方案,并说明理由。
解释说明:CH3COONH4属弱酸弱碱盐,虽强烈水解但溶液呈中性。同时,CH3COONH4溶液中也有大量NH4+,若Mg(OH)2没有溶解,说明甲同学的解释正确。若Mg(OH)2溶解,则说明乙同学的解释正确。
【投影演示】
根据同学的实验方案演示实验,并肯定学生的分析解释。
观察并记录实验现象:
Mg(OH)2悬浊液变澄清。
【评述】
实验说明乙同学的解释更合理。NH4+与OH-结合生成更难电离的NH3?H2O,从而使Mg(OH)2 的溶解平衡右移溶液变澄清。
【提问】
实验( 2)向FeCl3溶液中滴加NaHCO3 为什么有少量气泡逸出,溶液变为浅棕红色?
讨论解释其原因:
1.解释说明化学事实
【投影演示】
(1)向盛有少量Mg(OH)2 悬浊液培养皿中加入适量的饱和氯化铵溶液。
(2)向盛有FeCl3溶液的培养皿中滴加少量NaHCO3溶液。
【提问】
请结合两个实验现象讨论分析并解释说明为什么实验(1)Mg(OH)2悬浊液变澄清?
观察实验,记录现象:
(1)溶液变澄清。
(2)有少量气泡产生,溶液呈浅棕红色。
讨论解释其原因:

为主,溶液显酸性。
2.大多数盐水解程度较小,多元弱酸的酸根分步水解,以第一步水解为主。
1.谁弱谁水解,谁强显谁性,越弱越水解,都弱都水解,两强不水解。

【提问】
通过比较归纳,在水中加酸、加碱、加某些盐,对水的电离平衡分别产生怎样的影响?
【过渡】
在前面的学习中,我们总结过盐类水解的规律,请同学们回忆盐类水解有哪些规律。
【过渡】
下面我们来探讨应用水解规律分析解决具体问题。
归纳回答:
在水中加酸、加碱,会抑制水的电离,使水电离度减小。水中加入强酸弱碱盐或强碱弱酸盐,会促进水的电离,使水的电离度增大。
回忆盐类水解规律:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com