
2.溶液中微粒浓度大小的比较
【投影】例7
下列溶液中,离子浓度大小的排列顺序错误的是 [ ]
3.例如NaHSO4、HSO4-只电离不水解,溶液呈酸性。 NaHCO3、NaHS、Na2HPO4中的酸式酸根离子水解程度大于其电离程度,溶液呈碱性。而NaH2PO4中H2PO4-的电离程度大于水解程度,因此溶液显酸性。
【过渡】
电解质溶液中有关离子浓度大小的比较是近年高考题中常涉及的考题。
【板书】
3.酸式盐的水溶液一定显酸性吗?举例说明:对于酸式盐溶液酸碱性的判断,取决于酸式酸根电离与水解程度的相对大小。
2.盐溶液pH=7不一定是不水解的强酸强碱盐,例如CH3COONH4在水溶液中NH4+、CH3COO-都要发生水解,水解所产生的CH3COOH和NH3?H2O在相同条件下电离度几乎相等,因此溶液也呈中性。
2.pH=7的盐溶液一定是强酸强碱盐吗?
举例说明。
1.根据水解规律,“越弱越水解,两强不水解”,强碱弱酸盐溶液的碱性越强,其相应弱酸的酸性就越弱。同理,强酸弱碱盐溶液的酸性越强,其相应弱碱的碱性就越弱。
1.根据例6的分析,能水解的盐溶液的酸碱性与其组成有何关系?
讨论分析:
由于AC溶液pH=7,AD溶液pH>7,
说明D-为弱酸根离子,且D-的水解程度大于C-,因此,它们相应酸的酸性:HC>HD。又因AC溶液pH=7,BC溶液pH<7,说明B+为弱碱阳离子,且水解程度大于A+,因此,它们相应碱的碱性:AOH>BOH。
讨论回答:
由一价离子组成的四种盐溶液AC、BD、AD、BC,浓度均为0.1mol/L,在室温下前两种溶液的pH=7,第三种溶液pH>7,最后一种溶液pH<7。根据水解规律分析这四种盐中阴阳离子所对应的酸、碱的相对强弱是怎样的?
【提问】
NH2Cl作用相当于氯气, Cl2+H2O=
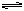 HCl+HClO。因此,NH2Cl+H2O=NH3+HClO,HClO具有强氧化性,可消毒杀菌,也可将FeSO4中Fe2+氧化为Fe3+。生成的Fe3+水解Fe3++3H2O
HCl+HClO。因此,NH2Cl+H2O=NH3+HClO,HClO具有强氧化性,可消毒杀菌,也可将FeSO4中Fe2+氧化为Fe3+。生成的Fe3+水解Fe3++3H2O
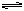 Fe(OH)3+3H+,产生的Fe(OH)3胶体具有吸附作用,可净化改善水质。
Fe(OH)3+3H+,产生的Fe(OH)3胶体具有吸附作用,可净化改善水质。
【投影】例5
试分析将下列物质的水溶液蒸干灼烧,最后得到的固体物质是什么?
解释原因。
(1)AlCl3
(2)KAl(SO4)2
(3)K2CO3
讨论回答:
(1)得Al2O3固体;Al3+发生水解生成Al(OH)3和HCl,由于加热时HCl不断挥发,促进水解平衡正向移动,而Al(OH)3在灼烧时分解,因此,最终为Al2O3固体。
(2)得KAl(SO4)2;尽管Al3+水解生成Al(OH)3和H2SO4,但由于H2SO4是高沸点酸,不易挥发,K2SO4不水解,也不易分解,加热最终只是把水蒸去,因此仍得KAl(SO4)2 固体。
(3)得K2CO3固体;尽管加热过程促进K2CO3水解,但K2CO3水解生成的KHCO3与KOH反应后仍为K2CO3。
适时引导讨论并给予肯定和表扬。
【投影】例6
失去磷肥功效,而氨水、K2CO3 的水溶液均显碱性,亦有相同影响。因此最佳组合为KCl、Ca(H2PO4)2、(NH4)2SO4,即②、③、④。
【投影】例4
城市自来水厂供给居民的生活用水,常先用氯胺NH2Cl(强氧化剂作用相当于氯气)再用绿矾FeSO4?7H2O来消毒、净化、改善水质。试根据水解原理分析解释其原因,写出其方程式。
分析讨论:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com