
2.两溶液相互混合后,判断离子浓度大小时要注意什么问题?
讨论回答:
1.判断能水解的盐溶液中离子浓度大小时要明确哪些平衡关系?
答案为C。</PGN0090.TXT/PGN>
【提问】
根据对例7的讨论分析:
D中CH3COOK+HCl=KCl+CH3COOH,且知,CH3COOK过量,反应后溶液中CH3COOK、CH3COOH、KCl物质的量相等,由于CH3COOH的电离和CH3COO-的水解程度均很小,且此时CH3COOH的电离占主导地位。因此[CH3COOH]>[H+]、[H+]>[OH-],又因[Cl-]=0.05 mol/L、[CH3COO-]>0.05 mol/L、[CH3COOH]<0.05 mol/L,因此D正确。
C中pH=2盐酸[H+]=1.0×10-2= [HCl],而pH=12的氨水[OH-]=1.0 ×10-2,但[NH3?H2O]则远大于1.0×10-2,等体积混合后,因氨水过量,在NH4Cl与氨水的混合液中,溶液显碱性。所以[NH4+]>[Cl-]>[OH-]>[H+],C错误。
D.0.2 mol/LCH3COOK和HCl等体积混合
[CH3COO-]>[Cl]>[CH3COOH]>[H+]
讨论分析:
根据NH4Cl的电离及炔NH4+水解溶液呈酸性,因此A正确。而
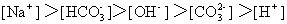
C.pH=2盐酸与pH=12氨水等体积混合
[Cl-]>[NH4+]>[H+]>[OH-]
B.0.1mol/L碳酸氢钠溶液中
A.0.1mol/L氯化铵溶液中
[Cl-]>[NH4+]>[H+]>[OH-]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com