
CO2=0.01 mol NaOH=0.1mol
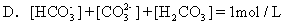
讨论分析:
将标准状况下体积为2.24LCO2缓缓通入100mL1mol/LNaOH溶液中(溶液体积变化忽略不计),反应结束后,溶液中有关离子物质的量浓度的关系正确的是 [ ]
答案为A、D。</PGN0091.TXT/PGN>
【投影】例9
HS-+H2O
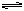 H2S+
H2S+
①根据电荷守恒:
[Na+]+[H+]=2[S2-]+[HS-]+[OH-],所以B正确。
②根据物料守恒:(钠与硫的物质的量2∶1)
[Na+]=2[S2-]+2[HS-]+2[H2S],所以A错误。
根据由水电离产生H+与OH-守恒:(①、②两式相减)
[OH-]=[HS-]+[H+]+2[H2S],所以D错误。
S2-+H2O
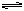 HS-+
HS-+
Na2S=2Na++S2- H2O 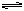 H++OH-
H++OH-
2.两溶液混合后离子浓度大小的比较,要首先分析相互间反应时是弱酸(或弱碱)剩余,虽然生成的盐的水解也要考虑,但剩余弱酸(或弱碱)的电离占主导地位。
【过渡】
在比较溶液中离子浓度时还常常用到电解质溶液中的两个重要守恒关系:电荷守恒,物料守恒。
【板书】
电荷守恒:电解质溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数。
物料守恒:某一分子或离子的原始浓度应等于它在溶液中各种存在形式的浓度之总和,即元素的原子守恒。
抄写笔记。
【投影】例8
在Na2S溶液中下列关系不正确的是
A.[Na+]=2[HS-]+2[S2-] +[H2S]
B.[Na+]+[H+]=[
C.[Na+]>[S2-]>[OH-]>[HS-]
D.[
【启发引导】
解答这类题目的思路是:首先确定溶液中各平衡关系及其微粒,然后再分析微粒间的各种守恒关系。
讨论分析:
Na2S溶液中存在下列平衡:
1.盐的电离平衡、水的电离平衡、盐中弱酸离子或弱碱离子的水解平衡。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com