
3.25℃,在0.1mol/L NaX溶液中,水的电离度为a1;在0.1mol/L盐酸中,水的电离度为a2,若a1/a2=109,则NaX溶液的pH约为 [ ]
A.5 B.7 C.10 D.11
2.浓度为0.1mol/L的下列各物质的溶液中,[NH4+]最大的是 [ ]
A.NH4Cl
B.NH4HSO4
C.NH3?H2O
D.CH3COONH4
D.0.1mol/LNa2SO4
C.0.2mol/LKCl
B.0.1mol/LNa2CO3
A.0.2mol/LCuSO4
1.等体积下列溶液中,阳离子的总物质的量最大的是 [ ]
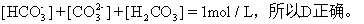
答案为A、D。
【投影】例10
已知一溶液中有四种离子:X+、Y-、H+、OH-,下列分析结果肯定错误的是 [ ]
A.[Y-]>[X+]>[H+]>[OH-]
B.[X+]>[Y-]>[OH-]>[H+]
C.[H+]>[Y-]>[X+]>[OH-]
D.[OH-]>[X+]>[H+]>[Y-]
讨论分析:
题目中四种离子在溶液中一定存在电荷守恒。
即[X+]+[H+]=[Y-]+[OH-],
根据此等式分析四个选项,
对A选项[Y-]>[X+],必有[H+]>[OH-];
对B选项[X+]>[Y-],必有[OH-]>[H+],才能使等式成立;
对C选项[H+]>[Y-],必有[OH-]>[X+],所以C选项错误;
对D选项[OH-]>[X+],必有[H+]>[Y-],这样等式成立。
答案为C。
【归纳】
电解质溶液中离子浓度大小的比较尽管复杂,但解题关键是抓住平衡主线,认真分析并按照离子的电荷守恒,物料守恒(元素的原子守恒)理清关系,就可快速解答。
精选题
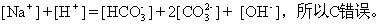
根据碳元素的原子守恒:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com