
4.(1)负极:Zn―2e→Zn2+正极:O2+4e+2H2O→4OH-
(2)强碱
(3)CuSO4总反应式:2CuSO4+2H2O  2Cu+2H2SO4+O2↑
2Cu+2H2SO4+O2↑
总反应式:2HCl  H2↑+Cl2↑
H2↑+Cl2↑
(2)KOH 阳极:4OH--4e→2H2O+O2↑阴极:4H++4e→2H2↑
3.(1)HCl 阳极:2Cl-―2e→Cl2↑阴极:2H++2e→H2↑
1.D 2.B
(4)已知电子电量为1.6×10
答 案
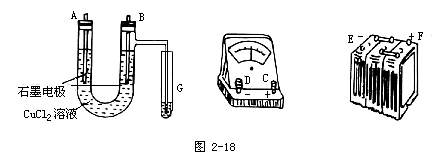
②在电流强度为IA,通电时间为ts后,精确测得某电极上析出的铜的质量为mg。试回答:
(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示。下同)E接____,C接____,接F____。
实验电路中的电流方向为____→____→____→C→____→____。
(2)写出B电极上发生反应的离子方程式______。
G试管中淀粉KI溶液变化的现象为______,相应的离子方程式为______。
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序是______。
①称量电解前电极质量
②刮下电解后电极上的铜并洗净
③用蒸馏水清洗电解后电极
④低温烘干电极后称量
⑤低温烘干刮下的铜后称量
⑥再次低温烘干后称量至恒重
6.某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
①用直流电电解氯化铜溶液,所用仪器如图2-18。
5.定温下,将一定量饱和Na2SO4溶液用铂电极通电电解。当阳极逸出amol气体时,同时从溶液中析出mgNa2SO4?10H2O晶体,则原来饱和Na2SO4溶液的质量分数是____。
4.正在研究应用锌顶替铅的电池,它可以减少环境污染容量又很大,其电池反应为2Zn+O2=ZnO,其原料为锌和电解质溶液、空气。请写出:
(1)电极反应____,____。
(2)估计该电解质溶液应该用____(强的酸或强的碱)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com