
(3)据上述分析得:只有A不正确。</PGN0051.TXT/PGN>
【投影】例8 在周期表主族元素中,甲元素与乙、丙、丁三元素上下或左右紧密相邻。甲、乙两元素的原子序数之和等于丙元素的原子序数。这四种元素原子的最外层电子数之和为20。据此可以判断:元素甲为______,元素丙为______,元素乙和丁所形成化合物的分子式为______或______。
【组织讨论】请讨论解题思路并求解。
读题,分析及解答:
依据元素周期表中元素位―构―性三者之间的关系,利用题给信息,确定突破口:
(1)可以最外层电子数之和为20猜想,甲的最外层电子数在5左右;
(2)可以甲元素与乙、丙、丁三元素上下或左右紧密相邻,写出四种可能的位置关系,设出甲的序数,结合最外层电子数之和为20求解。
答案:甲为N,丙为P,乙和丁的化合物为CO或CO2。
【课堂小结】
精选题
【提问】我们请一位同学示范讲解本题的分析及推断过程。其他同学注意思考,有欠缺的地方予以补充。
读题,思考并回答:
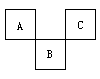
(1)由于 A、B、C是短周期元素,它们在表中的位置关系明确,因此,可设B的原子序数是x,则A的原子序数是(x-9),C原子序数是(x-7);
(2)又由于 A、B、C三种元素原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等,则有等式:
(x-9)+x+(x-7)=2x,则有x=16。
可知B为16号S元素,则A为N元素,C为F元素。
【过渡】现在我们来看例题:
【投影】例7 下图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数。B原子核内质子数和中子数相等。下面叙述中不正确的是 [ ]
A.三种元素的原子半径的大小顺序是B<A<C
B.A元素最高价氧化物的对应水化物具有强氧化性和不稳定性
C.B元素的氧化物,氢化物的水溶液都呈酸性
D.C元素的单质是非金属单质中唯一能跟水激烈反应的单质
【板书】2.元素性质的递变规律
(1)元素周期表中微粒半径的递变规律
【投影】例5 各组微粒的半径比较,正确的是 [ ]
①F<F-<Cl- ②O2-<Mg2+Al3+
③Ca2+<Ca<Ba ④S2-<Se2-<Br-
A.①③ B.②③
C.③④ D.①④
读题与解题。答案是A。
【组织讨论】请讨论解题思路并总结微粒半径比较的规律。
讨论,总结微粒半径比较的规律:
(1)同周期元素原子半径,随原子序数的递增而递减;
(2)同主族元素原子半径,随原子序数的递增而增大;
(3)同主族元素离子半径,随原子序数的递增也增大;
(4)具有相同电子层结构的阴阳离子,其半径随原子序数的递增而减小。
【评价】对学生的正确回答予以鼓励,并对发言中的问题和不完善之处予以补充。
【板书】(2)元素周期表中各元素单质性质的递变规律
【提问】周期表中元素单质的性质呈现怎样的变化规律?
思考,总结:
(1)同周期从左到右,随原子序数的递增,元素的金属性和单质还原性逐渐减弱;元素的非金属性和单质的氧化性逐渐增强。
(2)同主族从上到下,随原子序数的递增,元素的金属性和单质还原性逐渐增强;元素的非金属性和单质的氧化性逐渐减弱。
(3)位于分界线两边的元素一般具有两性。
【投影】通过实验证明:Na、Mg、Al、Fe这四种金属活动性的相对强弱。
【组织讨论】不仅要提出方案,还要说明实验操作的方法和应该看到的实验现象。
【评价】因为是复习,因此学生有可能提出各方面的依据或设想。在学生提出可能的方案后,引导学生对每一个方法都进行评价,让学生自己分析并说明为什么可行?为什么不行的道理。
这9种设想中,不能完全充分说明问题
的有:(1)、(4)、(7)、(8)和(9)。
【提问】哪些实验事实能够说明:S的非金属性比Cl要弱?
思考,讨论,设计并提出实验方案或实验事实:(学生可能的方案有)
(1)与氧气反应的难易程度;
(2)与水反应的难易程度;
(3)与水反应后生成的氢氧化物的碱性的相对强弱;
(4)与强酸反应产生氢气的剧烈程度;
(5)四种金属之间的置换反应;
(6)它们形成的强酸盐溶液的pH的大小(水解程度);
(7)它们对应的金属阳离子氧化性的相对强弱;
(8)这四种金属的冶炼方法;
(9)在自然界的存在形态。
【评价】与学生一起在讨论中评价每一个方案。
【板书】(3)最高价氧化物对应水化物的酸性或碱性,以及非金属元素气态氢化物的稳定性的递变规律
【投影】例6 已知同周期的X、Y、Z三元素的最高价氧化物的水化物的酸性由强到弱的顺序:HZO4>H2YO4>H3XO4,下列判断不正确的是 [ ]
A.阴离子的还原性按X、Y、Z的顺序减弱
B.单质的氧化性按X、Y、Z的顺序减弱
C.原子半径按x、Y、Z的顺序减小
D.气态氢化物的稳定性按X、Y、Z的顺序减弱
思考,归纳,回答:
可能的思路有:
(1)与氢化合的反应条件;
(2)生成的气态氢化物的热稳定性;
(3)Cl2通入H2S或硫化物的溶液中,能得到S单质的沉淀;
(4)Fe或Cu在其中燃烧时,所得产物中Fe或Cu元素的价态等等。
【提问】应该如何比较最高价氧化物对应水化物的酸性或碱性的相对强弱?
讨论,总结:
根据“最高价氧化物对应水化物的酸性或碱性,以及非金属元素气态氢化物的稳定性,取决于金属或非金属元素的活动性的相对强弱”的规律,本题应选B、D。
非金属元素气态氢化物的稳定性与非金属元素单质的氧化性有何内在联系?
思考,回答。
四、“位―构―性”的规律及应用
【引入】元素周期律揭示了元素之间的内在联系,元素周期表是元素周期律的具体体现形式。那么,这种元素间的内在联系表现在哪些方面?这些规律对于我们解决实际问题又有哪些具体的指导意义呢?
请同学们谈谈自己的体会和看法。
倾听,思考。
积极参加讨论,并发言。
思考,发言:
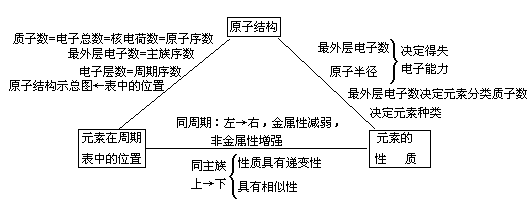
(1)原子序数=核电荷数=质子数=核外电子总数;
(2)由核外电子总数可知电子的排布,从而知道电子层数,推知该元素在周期表中的周期数;
(3)最外层电子数决定元素的化学性质;
(4)根据元素在周期表中的位置,可推知元素的化学性质。
【评价】只知道周期数,能否确定元素在周期表中的位置?对,还得知道它所在的族序数。
【评价】元素的化学性质难道只与最外层电子数有关吗?对,还与原子半径即电子层数的多少有关。
教师活动
【投影】现在我们来系统地归纳“位―构―性”三者之间的关系:元素“位―构―性”三者之间的关系小结:
所以此题应选C。</PGN0048.TXT/PGN>
②化合物中,原子个数比为1∶2,有两种形式:XY2或X2Y。其中XY2型的化合物,常见的有CO2、SO2、NO2以及ⅡA和ⅦA族元素之间形成的化合物,如MgCl2、BeF2等。
常见X2Y型的化合物如IA与ⅥA族之间的化合物如H2O、Na2O及N2O等。

(2)金属与非金属元素的分界线两边的元素有哪些?
思考并回答:把握金属与非金属元素的分界线两边的元素,如B、Al、Si等。
(3)掌握每个主族元素的名称、符号和序数。
练习书写主族元素的名称、符号和序数。
【投影】例4 两种短周期元素组成的化合物中,原子个数比为1∶2。若两种元素的原子序数分别为p和q,则对下列p和q可能的关系概括得最完全的是 [ ]
①p+q=15 ②p=q+5
③p=q-5 ④p+q=22
A.①④ B.①③④
C.①②③④ D.①②④
【组织讨论】请讨论解题思路并做答。
讨论、分析、回答:
①两种“短周期元素”,说明这两种元素的原子序数都小于18;

②周期的分类及各周期的元素数目
说明:
在此引导学生注意相邻两个短周期中元素原子序数之间的数量关系。
③族的分类
思考,归纳,发言。
倾听,回忆。
回忆,发言:
周期 元素数目
1.元素周期表的结构
【提问】元素周期表的主要特征有哪些?
(1)引导学生复习元素周期表的结构:
【板书】
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com