
2.向某待测无色溶液中滴入酚酞试剂,结果溶液呈红色,由此可得出的结论是( )
A.溴水 B.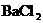 溶液 C.NaOH溶液 D.浓盐酸
溶液 C.NaOH溶液 D.浓盐酸
1.可用滴瓶存放较长时间的试剂是( )
 |
上述方案是否合理?______________。请简要说明两点理由:
①________________________________;②________________________________。
解析 本题是一道探究性实验试题,由大家熟知的Na2O2与CO2反应拓展到与具有还原性的SO2反应,不要求得出实验结论(因为没有亲自动手做),通过检验O2、SO42-等基础知识作为载体,考查了化学实验方案的设计与评价。
答案 ⑴2Na2O2+2SO2=2Na2SO3+O2 ⑵取白色固体,加稀硫酸,产生能使晶红溶液褪色的气体。 ⑶不合理 稀硝酸能将亚硫酸钡氧化为硫酸钡 如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根
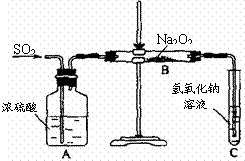

请回答下列问题:
⑴第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
__________________________________。
⑵请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
____________________________________________________________________
⑶第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
 |
气体
a
b
c
d
C2H4
乙醇
浓H2SO4
NaOH溶液
浓H2SO4
Cl2
浓盐酸
MnO2
NaOH溶液
浓H2SO4
NH3
饱和NH4Cl溶液
消石灰
H2O
固体NaOH
NO
稀HNO3
铜屑
H2O
P2O5
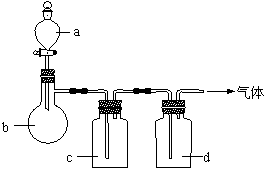
⑴上述方法中可以得到干燥、纯净的气体是 。
⑵指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体 ,理由是 。
②气体 ,理由是 。
③气体 ,理由是 。
④气体 ,理由是 。
解析 本题考查制取气体实验中根据已有装置选择反应物、除杂试剂和干燥剂的能力,其中有常规方法和非常规方法。
若制取乙稀,由于装置中没有温度计,无法控制反应温度,实验无法进行。后面的除杂试剂NaOH溶液(用于吸收CO2和SO2)和干燥剂浓H2SO4的选用都是正确的。
若用该装置制取氯气是可以的,用浓H2SO4对氯气进行干燥也是可以的。但要除去氯气中混有的HCl气体,c中应选用饱和食盐水。
我们熟悉的制取氨气的装置是以NH4Cl固体和消石灰作反应物的固体加热制气装置,用本题中装置和题给反应物也能制取氨气(a中也可以加入浓氨水),但c中的水能吸收氨气且能发生倒吸。若c中不加入任何物质倒是可以的。
若用该装置制取NO气体,制得的气体中可能混有NO2气体,c中用水能将NO2转化为NO,d中的P2O5起干燥作用。我们熟悉的干燥装置一般由两种:本题中d装置和干燥管(或U型管),d装置中一般装液体干燥剂如浓硫酸,干燥管(或U型管)中装入固体干燥剂。这里d装置中装入固体干燥剂是一种非常规方法。
答案 ⑴NO ⑵①C2H4 装置中没有温度计,无法控制反应温度 ②Cl2 反应生成的Cl2被c中的NaOH溶液吸收了 ③NH3 反应生成的NH3被c中的H2O吸收了
例5 (2004?江苏)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
(4)
例3 (2002?广东)已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器。)
请填写表中空格,完成由上述混合物得到固体甲的实验设计。
序号
实验步骤
简述实验操作(不必叙述如何组装实验装置)
①
溶解
将混合物放入烧杯中,加入98% H2SO4 ,充分搅拌直到固体不再溶解。
②
③
④
⑤
洗涤沉淀
⑥
检验沉淀是否洗净
解析 本题通过对混合物的分离考查实验设计和化学实验基本操作。
题中给出了信息“化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶”,又给出了第一步实验操作“将混合物放入烧杯中,加入98% H2SO4 ,充分搅拌直到固体不再溶解”。综合分析两个信息,应该知道实验设计的大体思路:用浓硫酸将甲溶解,过滤出乙后,滤液加入水中稀释同时析出甲,再过滤。
知道了实验设计的大体思路之后,就需要考虑操作的细节问题了:含浓硫酸的滤液与水混合时应怎样操作?过滤得到的沉淀物需要洗涤,怎样洗?怎样才算洗干净了?等等。
答案 ②过滤 将烧杯中物质倒入耐酸过滤器中过滤,得滤液
③析出沉淀 将滤液沿烧杯壁慢慢倒入足量水中,并不段搅拌,直至析出全部固体
④过滤 将此烧杯中的物质倒入过滤器中过滤,得固体
⑤用蒸馏水冲洗滤纸上的固体若干次,直至洗净
⑥取新得到的洗出液少许,滴入用盐酸酸化的BaCl2 溶液 ,若没有白色浑浊出现,则说明沉淀已洗净,若有白色浑浊出现,则说明沉淀没有洗净
例4 (2003?江苏)拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
⑷如果实验中得到的氧气体积是c L(25℃、1.0×105Pa)的,水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):
M(O2)= 。
解析:本题较全面的考查化学实验,包括的考点有实验的操作、原理、数据的采集和处理,利用常用的中学仪器作定量的实验。解答本题时⑴、⑶两个问题时要注意文字表达要简洁、准确、到位,解答第⑵问时要注意温度、压强对气体体积的影响,最后数据处理时要注意单位以及把298K下体积换算成273K时的体积。
答案:(1)将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气。
(2)②①③ (3)慢慢将量筒下降
 ②装好实验装置。
②装好实验装置。
③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图,导管出口高于液面)。
⑥测量收集到气体的体积。
⑦准确称量试管和残留物的质量为b g。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
回答下列问题:
⑴如何检查装置的气密性?
⑵以下是测量收集到气体体积必须包括的几个步骤;①调整量简内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量简内气体的体积。这三步操作的正确顺序是: (请填写步骤代号)。
⑶测量收集到气体体积时,如何使量筒内外液面的高度相同?
答案 ⑴4HCl+MnO2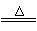
 MnCl2+2H2O+Cl2↑或16HCl+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2↑ ⑵B中的反应进行一段时间后,看到共绿色气体充满装置,再开始加热D
⑶2Fe+3Cl2
MnCl2+2H2O+Cl2↑或16HCl+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2↑ ⑵B中的反应进行一段时间后,看到共绿色气体充满装置,再开始加热D
⑶2Fe+3Cl2
 2FeCl3 ⑷导管易被产品堵塞,尾气排入空气,易造成环境污染 ⑸产品易受潮解 在瓶E和F之间连接装有干燥剂的装置(其他既能防止产品潮解又能防止尾气污染环境的合理答案均给分)
2FeCl3 ⑷导管易被产品堵塞,尾气排入空气,易造成环境污染 ⑸产品易受潮解 在瓶E和F之间连接装有干燥剂的装置(其他既能防止产品潮解又能防止尾气污染环境的合理答案均给分)
例2 (2001?全国)某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为a g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com