
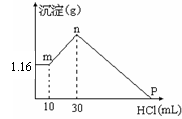
 29.(本题6分)把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量的水中,有
29.(本题6分)把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量的水中,有
(1)写出mn段反应的离子方程式__________________
(2)混合物中NaOH的物质的量是____________,AlCl3的
物质的量是___________,MgCl2的物质的量是___________。
(3)P点所表示的加入盐酸的体积是_________mL。
(5)已知饱和食盐水150 mL,电流强度为I A,通电为t min时,测得H2体积为16.8 mL(标准状况),此时溶液的pH约为________,阿伏加德罗常数NA的表达式为________________
(电子电量为1.6×10-
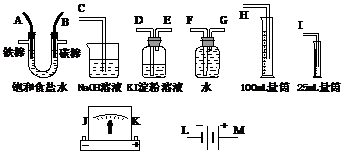 |
(1)A极发生的电极反应式是______________,B极发生的电极反应式是_____________。
(2)电源、电流表与A、B两极的正确连接顺序为L→ ( )→ ( )→ ( )→ ( )→ M。
(3)设计上述气体实验装置时,各接口的正确连接顺序为:______接______、______接A、B接______、______接______。
(4)证明Cl2具有氧化性的实验现象是___________________,其中发生反应的离子方程式是______________________________。
28.(本题15分)请从下图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的H2的体积(大于25 mL),并检验Cl2的氧化性。

请回答下列问题:
(1)X、Y、Z、W原子对应的离子半径由小到大的顺序是 (填离子符号)。
(2)用电子式表示X、Z所形成的化合物的形成过程 。
(3)写出上述转化关系中生成溶液Ⅱ的反应的离子方程式: 。
(4)检验溶液Ⅲ中金属阳离子的方法为 。
27.(本题8分)X、Y、Z、W是原子序数依次增大的同一短周期的元素,它们形成的单质中有2种为金属,1种为气体;Z元素的次外层电子数与其它各层的电子数之和相等。X、Y、W所形成的单质与其他物质之间的反应关系如下图:

⑷纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 。
26.(本题8分)某反应体系中的物质有: NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
⑴请将Au2O3之外的反应物与生成物分别填入以下空格内并配平。
|