
10.某单质A是固体,不溶于水,物质B与I均为溶于水的气体,按图发生转化,图中只给出元素A的产物,写出以下转化反应的配平的化学方程式。
|
 C
C D
D E
E F
F
|

|
|
 A
A B
B G
G H
H A + B + E
A + B + E
 I
I J
J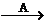 K
K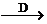 A + I + E
A + I + E
(B)
9.四氮化四硫(S4N4)是氮化硫类化合物中的一个。它可由二氯化二硫和氨合成为橙色晶体,撞击或加热时易爆炸……
(1) 写出由二氯化二硫和氨形成S4N4的反应式。
(2) 能否用N2与S合成S4N4?为什么?
8.水中溶解氧的实验滴定测定,涉及以下一些反应,写出反应方程式
(1) 在碱性溶液中,溶解氧与Mn(OH)2反应
(2) 在酸性条件下,Mn(III)水合氧化物与碘离子反应
(3) 碘与硫代硫酸钠溶液反应
7.写出下列化学反应的配平的方程式
 [提示:2K(Na) + K2O2(Na2O2) 2K2O(Na2O)]
[提示:2K(Na) + K2O2(Na2O2) 2K2O(Na2O)]
 (1) Na + NaOH(l)
(1) Na + NaOH(l)
 (2) K + KNO3
(2) K + KNO3
 (3) CeO2 +
H2SO4
(3) CeO2 +
H2SO4

 (4) NH4Hg
(4) NH4Hg
6. 近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途。我国学者提出在浓NaOH溶液中用电化学法来制备高铁酸盐[FeO42-],电解装置如右图。在电解过程中阳极上发生的电极反应为 ① ,阴极上发生的电极反应为
② ,总电解反应方程式为
③ ;电解一段时间后,在阳极上收集到气体为1.12dm3,在阴极上收集到气体为8.96dm3,(已换成标准状态),那么获得的高铁酸盐的物质的量为
④ ,阳极区周围溶液的pH ⑤ (填升高、降低或不变)。
近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途。我国学者提出在浓NaOH溶液中用电化学法来制备高铁酸盐[FeO42-],电解装置如右图。在电解过程中阳极上发生的电极反应为 ① ,阴极上发生的电极反应为
② ,总电解反应方程式为
③ ;电解一段时间后,在阳极上收集到气体为1.12dm3,在阴极上收集到气体为8.96dm3,(已换成标准状态),那么获得的高铁酸盐的物质的量为
④ ,阳极区周围溶液的pH ⑤ (填升高、降低或不变)。
5.辉钼矿(MoS2)是最重要钼矿,它在130℃、202650Pa氧压下,跟苛性碱溶液反应时,钼以钼酸根(MoO42-)形式进入溶液。
(1) 在上述反应中硫也氧化而进入溶液。试写出上述反应的配平方程式。
(2) 在密闭容器中用硝酸来分解辉钼矿,氧化过程的条件为150℃-250℃、114575-1823850Pa氧压。反应结果钼以钼酸形态沉淀,而硝酸的实际消耗量很低(相当于催化作用),为什么?试通过化学方程式来解释。
3.用离子电子法配平下列各反应方程式
(1) PH4+ + Cr2O72-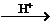 P4+ Cr3+
P4+ Cr3+
(2) ClO- + Fe(OH)2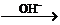 Cl- + FeO42-
Cl- + FeO42-
(3) CuO + NH3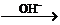 Cu + N2
Cu + N2
(4) Zn + CNS-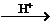 Zn2+ + H2S + HCN
Zn2+ + H2S + HCN
(5) CN- + O2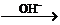 CO32- + NH3
CO32- + NH3
(6) Al + NO3- Al(OH)4- + NH3
Al(OH)4- + NH3
(7) Cu3P + Cr2O72- Cu2+ + H3PO4 + Cr3+
Cu2+ + H3PO4 + Cr3+
(8) Fe + NO2- FeO22- + NH3
FeO22- + NH3
(9) Cr(OH)4- + H2O2 CrO42- + H2O
CrO42- + H2O
(10) N2H4 + Cu(OH)2 N2 + Cu
N2 + Cu
(11) MnO4- + H2C2O4 Mn2+ + CO2
Mn2+ + CO2
(12) Cr(NCS)64-(aq) + Ce4+(aq) Cr3+(aq) + Ce3+(aq)
+ NO3-(aq) + CO2(g) + SO42-(aq)
Cr3+(aq) + Ce3+(aq)
+ NO3-(aq) + CO2(g) + SO42-(aq)
(13) Zn + NO3- NH3 + Zn(OH)42-
NH3 + Zn(OH)42-
(14) PbO2 + Mn2+ MnO4- + Pb2+
MnO4- + Pb2+
(15) CrO42- + S2O32- + H+ SO42- + Cr3+ + H2O
SO42- + Cr3+ + H2O
|
|
     Fe2+ + S22-
Fe3+ + FeS2(s)
Fe2+ + S22-
Fe3+ + FeS2(s)
|
(1) 试写出①-⑤的反应的离子方程式。
(2) 用Fe2(SO4)3溶液洗去煤中的FeS2的洗涤液经过简单的处理后可以循环使用,为什么?
2.用氧化数法配平下列各反应方程式
 (1) Fe3C
+ HNO3 Fe(NO3)3
+ NO + CO 2+ H2O
(1) Fe3C
+ HNO3 Fe(NO3)3
+ NO + CO 2+ H2O
 (2) CrI3 + Cl2 + KOH K2CrO4
+ KIO3 + KCl + H2O
(2) CrI3 + Cl2 + KOH K2CrO4
+ KIO3 + KCl + H2O
 (3) MoS2 + O2 + NaOH Na2MoO4
+ Na2SO4 + H2O
(3) MoS2 + O2 + NaOH Na2MoO4
+ Na2SO4 + H2O
 (4) P4 + NaOH + H2O NaH2PO2 + PH3
(4) P4 + NaOH + H2O NaH2PO2 + PH3
 (5) HCNS + KClO3 CO 2+
NO + SO2 + KCl +H2O
(5) HCNS + KClO3 CO 2+
NO + SO2 + KCl +H2O
(6) 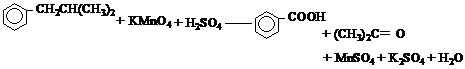
 (7) Pb(N3)2 + Cr(MnO4)2 Cr2O3
+ MnO2 + NO + Pb3O4
(7) Pb(N3)2 + Cr(MnO4)2 Cr2O3
+ MnO2 + NO + Pb3O4
 (8) P 4+ P2I4 + H2O PH4I
+ H3PO4
(8) P 4+ P2I4 + H2O PH4I
+ H3PO4
(A)
1.试写出下列各题中,中心原子的氧化数(S、Mn、P)
(1) Na2Sx、H2SO4、Na2S2O3、H2S、Na2S4O6、S8、K2S2O8、H2SO5、S4Cl2
(2) MnF2、MnO3F、K4[Mn(CN)6]、K2MnO4、Mn2(CO)10、Mn(CO)4(NO)
(3) H3PO4、P4O6、H3PO2、PH4+、H3PO3、H2PO4-、P4、H4P2O7、P2H4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com